题目内容
12.智利硝石矿中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为2NaIO3+5NaHSO3═3NaHSO4+2Na2SO4+1I2+1H2O
请回答下列问题.
(1)配平该反应方程式
2NaIO3+5NaHSO3═3NaHSO4+2Na2SO4+1I2+1H2O
反应中硫元素被氧化,NaIO3是氧化剂.
(2)若反应中生成0.25mol I2,则参加反应的氧化剂的质量为99g.
(3)若反应后还原剂完全反应,向反应后的混合液中加入一定量的Ba(OH)2溶液至溶液恰好呈中性(不考虑I2的影响),反应的离子方程式为2H++2OH-+Ba2++SO42-═2H2O+BaSO4↓.
(4)在硫酸酸化条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式并配平5H2S+2KMnO4+3H2SO4═K2SO4+2MnSO4+8H2O+5S.
分析 (1)反应中碘元素化合价变化:+5→0;硫元素化合价变化:+4→+6;依据得失电子守恒、结合原子个数守恒书写方程式;氧化还原反应中,所含元素化合价升高的被氧化,做还原剂,所含元素化合价降低被还原,做还原剂;
(2)依据方程式计算消耗氧化剂的质量;
(3)因至溶液呈中性,即H+与OH-恰好完全反应;
(4)H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,结合质量守恒、得失电子守恒书写化学方程式;
解答 解:(1)I元素的化合价由+5价降低为0,碘酸钠为氧化剂,S元素的化合价由+4价升高为+6价,硫元素被氧化,要使氧化剂得到电子数等于还原剂失去电子数,则碘酸钠系数为2,亚硫酸氢钠系数为5,依据原子个数守恒,反应方程式:2NaIO3+5NaHSO3═3NaHSO4+2NaSO4+I2+H2O;
故答案为:2NaIO3+5NaHSO3═3NaHSO4+2NaSO4+I2+H2O;硫;NaIO3;
(2)依据方程式可知:
2NaIO3+5NaHSO3═3NaHSO4+2NaSO4+I2+H2O
198×2 1
m 0.25mol
解得m=99g;
故答案为:99;
(3)因至溶液呈中性,即H+与OH-恰好完全反应,以2:1反应生成硫酸钡和水,离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,
故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
(4)H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,反应的方程式为3H2SO4+5H2S+2KMnO4=5S↓+2MnSO4+K2SO4+8H2O,
故答案为:3H2SO4+5H2S+2KMnO4=5S↓+2MnSO4+K2SO4+8H2O;
点评 本题考查了氧化还原反应方程式书写、有关计算,明确氧化还原反应基本概念、得失电子守恒规律是解题关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 漂白粉的有效成分是CaCl2 | |
| B. | 漂白粉和明矾处理自来水的原理是相同的 | |
| C. | 漂白粉最好在弱酸性环境下使用 | |
| D. | 漂白粉因易在空气中氧化而密封保存 |
| 25℃平衡体系 | HA起始总浓度 |
| 在水中,HA═H++A- | 4.0×10-3mol•L-1 |
| 在苯中,2HA═(HA)2 | 5.0×10-3mol•L-1 |
?6C(s)+5H2(g)+3N2(g)+9O2(g)═2C3H5(ONO2)3(l)△H1
?2H2(g)+O2(g)═2H2O(g)△H2
?C(s)+O2(g)═CO2(g)△H3
则反应12CO2(g)+10H2O(g)+O2(g)+6N2(g)═4C3H5(ONO2)3(l)的△H为( )
| A. | 12△H3+5△H2-2△H1 | B. | 2△H1-5△H2-12△H3 | C. | 12△H3-5△H2-2△H1 | D. | △H1-5△H2-12△H3 |
已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;
②0.1mol/L 乙溶液的pH<1(在常温下);
③向丙溶液中滴入AgNO3溶液,有不溶于稀硝酸的白
色沉淀生成.下列结论不正确的是( )
| A. | 甲溶液中含有HCO3- | B. | 乙溶液中含有SO42- | ||
| C. | 丙溶液中含有Mg2+ | D. | 丁溶液中含有NH4+ |
| A. | 2CO(g)+O2(g)═2CO2(g)△H=-141.3kJ•mol-1 | |
| B. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-141.3kJ•mol-1 | |
| C. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.6kJ•mol-1 | |
| D. | CO(g)+O2(g)═CO2(g)△H=-141.3kJ•mol-1 |
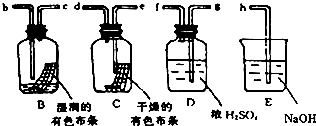
 第二周期中碳、氮、氧是构成生命物质的三种主要元素,在生产生活中也有着重要的应用.
第二周期中碳、氮、氧是构成生命物质的三种主要元素,在生产生活中也有着重要的应用.