题目内容
3.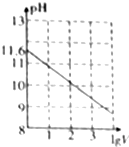 常温下,1ml 0.10mol•L-1K2CO3溶液,加水稀释至体积为Vml,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
常温下,1ml 0.10mol•L-1K2CO3溶液,加水稀释至体积为Vml,pH随lgV的变化情况如图所示,下列叙述中正确的是( )| A. | 0.10mol•L-1的K2CO3溶液中由水电离出的c(OH-)═10-11.6mol•L-1 | |
| B. | 0.10 mol•L-1的K2CO3溶液中:2c(K+)═c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 当lgV=2时,若K2CO3溶液升高温度,溶液碱性增强,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$-)减小 | |
| D. | 当lgV=3时,K2CO3溶液中:c(OH-)═c(H+)+c(HCO3-)+2c(H2CO3) |
分析 A.碳酸钾溶液中,碳酸根离子水解促进了水的电离,溶液中氢氧根离子浓度是水电离的;
B.根据碳酸钾溶液中的物料守恒判断;
C.升高温度后,碳酸根离子的水解程度增大,碳酸根离子浓度减小、碳酸氢根离子浓度增大,则该比值增大;
D.根据碳酸钠溶液中的质子守恒判断.
解答 解:A.0.10mol•L-1的K2CO3溶液的pH=11.6,溶液中c(H+)═10-11.6mol•L-1,碳酸根离子水解促进了水的电离,溶液中氢氧根离子是水电离的,则由水电离出的c(OH-)═10-2.4mol•L-1,故A错误;
B.0.10 mol•L-1的K2CO3溶液中,根据物料守恒可得:c(K+)═2c(CO32-)+2c(HCO3-)+2c(H2CO3),故B错误;
C.碳酸根离子的水解为吸热反应,若K2CO3溶液升高温度,碳酸根离子的水解程度增大,则溶液碱性增强,碳酸根离子浓度减小、碳酸氢根离子浓度增大,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$的比值会增大,故C错误;
D.当lgV=3时,K2CO3溶液中满足质子守恒:c(OH-)═c(H+)+c(HCO3-)+2c(H2CO3),故D正确;
故选D.
点评 本题考查离子浓度大小比较,题目难度中等,明确电荷守恒、质子守恒及盐的水解原理的含义为解答关键,注意掌握水电离及其影响,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
12.将3.20g Cu跟50.0mL l0.0mol/L的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有xmolH+,则此时溶液中合NO3-的物质的量为( )
| A. | xmol | B. | (x+0.1)mol | C. | 2xmol | D. | 0.1xmol |
13.Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是 .如果要合成
.如果要合成 ,所用的原始原料可以是( )
,所用的原始原料可以是( )
 .如果要合成
.如果要合成 ,所用的原始原料可以是( )
,所用的原始原料可以是( )| A. | 2,3-二甲基-1,3-丁二烯和乙烯 | B. | 2,3-二甲基-1,3-丁二烯和乙炔 | ||
| C. | 1,3-丁二烯和2-丁炔 | D. | 1,3-丁二烯和2-丁烯 |
10.2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,有机物甲和乙为“分子马达”的关键组件.下列说法正确的是( )


| A. | 甲是苯的同系物,乙不是苯的同系物,甲乙瓦为同分异构体 | |
| B. | 甲、乙均能发生取代反应和加成反应 | |
| C. | 甲的一氯代物有2种,乙的一氯代物有7种(不考虑顺反异构) | |
| D. | 甲分子中所有原了可能在同一平面上,乙分子中所有原了一定在同一平面上 |
17.下列有关叙述正确的是( )
| A. | NH4F溶液不能存放于玻璃试剂瓶中 | |
| B. | 氮元素的非金属性强于磷,在常温下氮气活泼性也强于磷 | |
| C. | 苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应 | |
| D. | 二氧化硫和次氯酸的漂白原理不同,二氧化硫漂白时没有发生化学变化 |
8.T℃时,在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示.则下列结论不正确的是( )
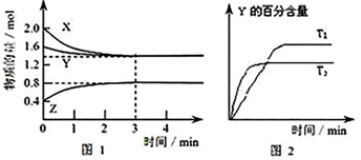

| A. | 容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | |
| B. | 反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L•min) | |
| C. | 据图2可知,相对于T1,温度为T2时更快达到“拐点”,说明T2时化学反应速率更快,可确定温度T2高于T1 | |
| D. | 若改变反应条件,使反应进程如图3所示,则改变的条件可能是使用了催化剂 |
15.下列微粒中同时具有离子键、共价键和配位键的化合物是( )
| A. | NH4Cl | B. | Na2O2 | C. | H3O+ | D. | MgO |
13. X、Y、Z是中学常见的三种单质,M、N是中学常见的两种化合物,其中M在常温下为液态,它们之间存在如图转化关系.下列有关说法错误的是( )
X、Y、Z是中学常见的三种单质,M、N是中学常见的两种化合物,其中M在常温下为液态,它们之间存在如图转化关系.下列有关说法错误的是( )
 X、Y、Z是中学常见的三种单质,M、N是中学常见的两种化合物,其中M在常温下为液态,它们之间存在如图转化关系.下列有关说法错误的是( )
X、Y、Z是中学常见的三种单质,M、N是中学常见的两种化合物,其中M在常温下为液态,它们之间存在如图转化关系.下列有关说法错误的是( )| A. | 该过程所涉及的反应均为氧化还原反应 | |
| B. | 当X单质为金属时,可能是Na或Fe | |
| C. | 当X单质为非金属时,可能是F2或 C | |
| D. | 反应①可能在常温下进行,也可能需要在高温下才能发生 |
 ,B的分子式C7H6O2,C的一种同分异构体的结构简式CH3CH2NO2.
,B的分子式C7H6O2,C的一种同分异构体的结构简式CH3CH2NO2.