题目内容
12.将3.20g Cu跟50.0mL l0.0mol/L的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有xmolH+,则此时溶液中合NO3-的物质的量为( )| A. | xmol | B. | (x+0.1)mol | C. | 2xmol | D. | 0.1xmol |
分析 n(Cu)=$\frac{3.20g}{64g/mol}$=0.05mol,n(HNO3)=10.0mol/L×0.05L=0.5mol,如果反应后溶液中还含有氢离子说明硝酸有剩余,根据氢离子物质的量计算剩余硝酸的物质的量,溶液中的溶质为硝酸铜、硝酸,根据硝酸铜、硝酸的物质的量计算硝酸根离子的物质的量.
解答 解:n(Cu)=$\frac{3.20g}{64g/mol}$=0.05mol,n(HNO3)=10.0mol/L×0.05L=0.5mol,如果反应后溶液中还含有氢离子说明硝酸有剩余,根据氢离子物质的量计算剩余硝酸的物质的量,溶液中的溶质为Cu(NO3)2、HNO3,溶液中n[Cu(NO3)2]=n(Cu)=0.05mol,根据N原子守恒得溶液中n(NO3-)=n(HNO3)+2n[Cu(NO3)2]=n(H+)+2n[Cu(NO3)2]=xmol+0.05mol×2=(0.1+x)mol,
故选B.
点评 本题考查氧化还原反应的计算,侧重考查分析、计算能力,明确溶液中的溶质成分是解本题关键,灵活原子守恒解答即可,题目难度不大.

练习册系列答案
相关题目
2.金属Na投入下列溶液中,既有气体又有白色沉淀产生的是( )
| A. | CuSO4 | B. | MgCl2 | C. | FeCl3 | D. | NaCl |
3.化学与生产和生活密切相关,下列说法错误的是( )
| A. | 从海水中可以获得NaCl,NaCl是生产纯碱的原料 | |
| B. | 硅的晶体可以作为光电转换材料用于太阳能电池 | |
| C. | 明矶净水的原理和“84”消毒液的原理相同 | |
| D. | 燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 |
20.“类推”是一种重要的学习方法,但有时会产生错误,下列类推结论正确的是( )
| A. | 向 澄清石灰水通入过量CO2,先有白色沉淀后沉淀消失;则向澄清石灰水通入过量SO2,也是先有白色沉淀后沉淀消失 | |
| B. | ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 | |
| C. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子 | |
| D. | 干冰(CO2)是分子晶体,则SiO2也是分子晶体 |
7. 电浮选凝聚法是工业上的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示.下列说法正确( )
电浮选凝聚法是工业上的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示.下列说法正确( )
 电浮选凝聚法是工业上的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示.下列说法正确( )
电浮选凝聚法是工业上的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示.下列说法正确( )| A. | 石墨电极上发生氧化反应 | |
| B. | 甲烷燃料电池中CO32-向空气一极移动 | |
| C. | 根据图示,物质A为CO2 | |
| D. | 为增强污水的导电能力,可向污水中加入适量乙醇 |
17.下列各组反应中最终肯定是白色沉淀的是( )
| A. | NaAlO2溶液中加入过量氨水 | |
| B. | Al 2(SO 4) 3溶液中加入过量KOH溶液 | |
| C. | FeCl2溶液中加入过量氨水 | |
| D. | MgSO4溶液中加入过量KOH溶液 |
4.下列各项比较不正确的是( )
| A. | 铷与水反应现象与钠相似 | B. | 还原性:K>Na>Li | ||
| C. | 熔点:Li>Na>K | D. | 碱性:LiOH>NaOH>KOH |
3.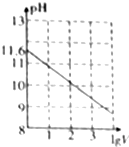 常温下,1ml 0.10mol•L-1K2CO3溶液,加水稀释至体积为Vml,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
常温下,1ml 0.10mol•L-1K2CO3溶液,加水稀释至体积为Vml,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
 常温下,1ml 0.10mol•L-1K2CO3溶液,加水稀释至体积为Vml,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
常温下,1ml 0.10mol•L-1K2CO3溶液,加水稀释至体积为Vml,pH随lgV的变化情况如图所示,下列叙述中正确的是( )| A. | 0.10mol•L-1的K2CO3溶液中由水电离出的c(OH-)═10-11.6mol•L-1 | |
| B. | 0.10 mol•L-1的K2CO3溶液中:2c(K+)═c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 当lgV=2时,若K2CO3溶液升高温度,溶液碱性增强,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$-)减小 | |
| D. | 当lgV=3时,K2CO3溶液中:c(OH-)═c(H+)+c(HCO3-)+2c(H2CO3) |
