题目内容
15.下列微粒中同时具有离子键、共价键和配位键的化合物是( )| A. | NH4Cl | B. | Na2O2 | C. | H3O+ | D. | MgO |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有孤电子对的原子和含有空轨道的原子之间存在配位键,据此分析解答.
解答 解:A、NH4Cl中铵根离子与氯离子以离子键结合,N、H元素形成的共价键,铵根离子中存在配位键,故A正确;
B、过氧化钠中含离子键和非极性共价键,不含配位键,故B错误;
C、H3O+中存大共价键和配位键,不含离子键,故C错误;
D、氧化镁中含离子键,不含共价键和配位键,故D错误;
故选A.
点评 本题考查化学键,明确离子键、共价键的成键规律即可解答,难度不大,需要注意的是铵根离子中存在配位键.

练习册系列答案
相关题目
4.下列各项比较不正确的是( )
| A. | 铷与水反应现象与钠相似 | B. | 还原性:K>Na>Li | ||
| C. | 熔点:Li>Na>K | D. | 碱性:LiOH>NaOH>KOH |
5.下列实验能获得成功的是( )
| A. | 取少量卤代烃加NaOH溶液共热,冷却,再加入AgNO3溶液检验卤素原子存在 | |
| B. | 向苯酚稀溶液中滴加浓溴水观察沉淀 | |
| C. | 苯与浓溴水反应制取溴苯 | |
| D. | 1 mol•L-1CuSO4溶液2 mL和0.5 mol•L-1NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 |
3.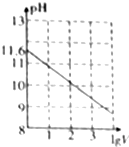 常温下,1ml 0.10mol•L-1K2CO3溶液,加水稀释至体积为Vml,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
常温下,1ml 0.10mol•L-1K2CO3溶液,加水稀释至体积为Vml,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
 常温下,1ml 0.10mol•L-1K2CO3溶液,加水稀释至体积为Vml,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
常温下,1ml 0.10mol•L-1K2CO3溶液,加水稀释至体积为Vml,pH随lgV的变化情况如图所示,下列叙述中正确的是( )| A. | 0.10mol•L-1的K2CO3溶液中由水电离出的c(OH-)═10-11.6mol•L-1 | |
| B. | 0.10 mol•L-1的K2CO3溶液中:2c(K+)═c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 当lgV=2时,若K2CO3溶液升高温度,溶液碱性增强,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$-)减小 | |
| D. | 当lgV=3时,K2CO3溶液中:c(OH-)═c(H+)+c(HCO3-)+2c(H2CO3) |
10.维生素C(C6H8O6)主要存在于蔬菜和水果中,它能促进人体生长发育,增强人体对疾病的抵抗力.近年来,科学家发现维生素C有防癌作用.下列关于维生素C的说法中错误的是( )
| A. | 维生素C是氧化物 | |
| B. | 维生素C由6个碳元素、8个氢元素、6个氧元素组成 | |
| C. | 维生素C中C、H、O三种元素的质量比为9:1:12 | |
| D. | 青少年应多吃蔬菜水果,切忌偏食 |
7.量取一定量的液体药品时,应将量筒水平放置,视线要跟量筒内液体的凹液面保持水平,再读出液体体积数.若观察时视线是仰视,则此时读出的液体体积数小于(填“大于”“等于”或“小于”)实际量取的液体体积数.
5.含有CO、N2、H2、CO2和少量水蒸气的混合气体,依次通过足量的灼热氧化铜、浓氢氧化钠溶液、浓硫酸后,剩余的气体是( )
| A. | N2 | B. | N2和H2 | C. | N2和CO2 | D. | H2和CO |