题目内容
13. X、Y、Z是中学常见的三种单质,M、N是中学常见的两种化合物,其中M在常温下为液态,它们之间存在如图转化关系.下列有关说法错误的是( )
X、Y、Z是中学常见的三种单质,M、N是中学常见的两种化合物,其中M在常温下为液态,它们之间存在如图转化关系.下列有关说法错误的是( )| A. | 该过程所涉及的反应均为氧化还原反应 | |
| B. | 当X单质为金属时,可能是Na或Fe | |
| C. | 当X单质为非金属时,可能是F2或 C | |
| D. | 反应①可能在常温下进行,也可能需要在高温下才能发生 |
分析 X、Y、Z是中学常见的三种单质,M、N是中学常见的两种化合物,反应①M+X=Y+N为置换反应,反应②X+Z=N,反应③为Y+Z=M是化合反应,其中M在常温下为液态,推断为水,据此分析.
A.分析可知反应中都存在单质参加或单质生成,反应过程中有元素化合价变化;
B.若X为钠其中反应②不能实现;
C.当X单质为非金属时,将C和F2带入验证;
D.根据反应①的反应判断.
解答 解:A.分析可知反应中都存在单质参加或单质生成,反应过程中有元素化合价变化,该过程所涉及的反应均为氧化还原反应,故A正确;
B.若X为钠其中反应②不能实现,Na和氧气反应不能一步生成氢氧化钠,若为铁和水的反应生成四氧化三铁和氢气,可以满足反应关系实现,故B错误;
C.当X单质为非金属时,可以是C,反应①为C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2,反应②为2C+O2=2CO,反应③为2H2+O2=2H2O,可以是F2,反应①为2F2+2H2O=4HF+O2,反应②为F2+H2=2HF,反应③为2H2+O2=2H2O,故C正确;
D.根据C的分析,反应①可以为C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2和2F2+2H2O=4HF+O2,所以可能在常温下进行,也可能需要在高温下才能发生,故D正确;
故选B.
点评 本题考查了无机推断、物质性质、反应类型和反应产物的分析判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
3.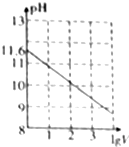 常温下,1ml 0.10mol•L-1K2CO3溶液,加水稀释至体积为Vml,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
常温下,1ml 0.10mol•L-1K2CO3溶液,加水稀释至体积为Vml,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
 常温下,1ml 0.10mol•L-1K2CO3溶液,加水稀释至体积为Vml,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
常温下,1ml 0.10mol•L-1K2CO3溶液,加水稀释至体积为Vml,pH随lgV的变化情况如图所示,下列叙述中正确的是( )| A. | 0.10mol•L-1的K2CO3溶液中由水电离出的c(OH-)═10-11.6mol•L-1 | |
| B. | 0.10 mol•L-1的K2CO3溶液中:2c(K+)═c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 当lgV=2时,若K2CO3溶液升高温度,溶液碱性增强,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$-)减小 | |
| D. | 当lgV=3时,K2CO3溶液中:c(OH-)═c(H+)+c(HCO3-)+2c(H2CO3) |
1.下列说法正确的是( )
| A. | 同温同压下甲烷和氧气的密度之比为2:1 | |
| B. | 等物质的量的甲烷和氧气的质量之比为2:1 | |
| C. | 1g甲烷和1g氧气的原子数之比为5:1 | |
| D. | 在标准状态下等质量的甲烷和氧气的体积比为1:1 |
5.含有CO、N2、H2、CO2和少量水蒸气的混合气体,依次通过足量的灼热氧化铜、浓氢氧化钠溶液、浓硫酸后,剩余的气体是( )
| A. | N2 | B. | N2和H2 | C. | N2和CO2 | D. | H2和CO |
2.2000年前的《神农本草经》就有麻黄能“治咳逆上气”额记载,它的结构简式为 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 麻黄的分子式为C10 H17O | |
| B. | 麻黄可以从植物中提取 | |
| C. | 麻黄在空气中燃烧有NO释出 | |
| D. | 麻黄的一溴代物有3种且可与HCl反应 |
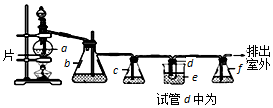
3.实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2,CH2=CH2+Br2→BrCH2CH2Br.用少量的溴和足量的乙醇制备l,2-二溴乙烷的装置如右图所示,有关数据如表:
回答下列问题:
(1)在装置c中应加入③(选填序号),其目的是吸收反应中可能生成的酸性气体.
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)将二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的下层.(填“上”或“下”)
(3)判断d管中制备二溴乙烷反应已结束的最简单方法是溴的颜色完全褪去.
(4)若产物中有少量未反应的Br2,最好用②(填正确选项前的序号)洗涤除去.
①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)以1,2-二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2-二溴乙烷通过(①)反应制得(②),②通过(③)反应制得氯乙烯,由氯乙烯制得聚氯乙烯.
①消去反应(填反应类型),其化学方程式 .
.
②加成反应(填反应类型).

| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在装置c中应加入③(选填序号),其目的是吸收反应中可能生成的酸性气体.
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)将二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的下层.(填“上”或“下”)
(3)判断d管中制备二溴乙烷反应已结束的最简单方法是溴的颜色完全褪去.
(4)若产物中有少量未反应的Br2,最好用②(填正确选项前的序号)洗涤除去.
①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)以1,2-二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2-二溴乙烷通过(①)反应制得(②),②通过(③)反应制得氯乙烯,由氯乙烯制得聚氯乙烯.
①消去反应(填反应类型),其化学方程式
 .
.②加成反应(填反应类型).