题目内容
12.由人尿分离出来的结晶化合物A,熔点为187℃~188℃.对化合物A作下列实验:(1)A的蒸气密度为8.0g•L-1(已折合成标准状况).取17.92g A完全燃烧,生成的气体通过浓H2SO4,浓H2SO4增重8.10g.剩余气体通过碱石灰,气体质量减轻39.60g.另取17.92g A完全分解,可得1.12L(标准状况)氮气.试通过计算确定A的分子式.
(2)又知A和足量6mol•L-1的盐酸混合加热可以完全水解,1mol A水解生成1mol B和1mol C.已知:A、B、C三种物质的分子中均含有一个羧基;B物质仅由碳、氢、氢、氧三种元素组成,其物质的量之比为7:6:2;C俗名为甘氨酸.写出:A的结构简式
 ,B的分子式C7H6O2,C的一种同分异构体的结构简式CH3CH2NO2.
,B的分子式C7H6O2,C的一种同分异构体的结构简式CH3CH2NO2.
分析 (1)先根据M=ρ×Vm求出相对分子质量,然后结合相对分子质量,根据质量守恒求出0.1molA各原子的个数,最后求出A的分子式;
(2)B物质仅由C、H、O三种元素组成,其物质的量之比为7:6:2,则分子式为C7H6O2,应为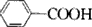 ,C的俗名为甘氨酸,为CH2(NH2)COOH,则A为
,C的俗名为甘氨酸,为CH2(NH2)COOH,则A为 ,以此解答该题.
,以此解答该题.
解答 解:(1)M(A)=8.0g/L×22.4L/mol=179.2g/mol,则相对分子质量为179.2,
取17.92gA完全燃烧,生成的气体通过浓硫酸,浓硫酸增重8.10g,即水的质量为8.10g,物质的量为$\frac{8.10g}{18g/mol}$=0.45mol,
剩余气体通过碱石灰,气体质量减少39.60g,即二氧化碳的质量为39.60g,物质的量为$\frac{39.60g}{44g/mol}$=0.9mol,
另取17.92gA完全分解,可得标准状况下氮气1.12L,物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,
所以0.1mol A可产生0.45mol H2O,0.9mol CO2和0.05mol N2,即1mol A 中含9mol C、9mol H、1mol N,
设A的分子式为C9H9NOX 则:9×12+9+14+16x=179.2,解得x=3,所以A的分子式是C9H9NO3,
答:A的分子式是C9H9NO3;
(2)B物质仅由C、H、O三种元素组成,其物质的量之比为7:6:2,则分子式为C7H6O2,应为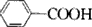 ,C的俗名为甘氨酸,为CH2(NH2)COOH,同分异构体为:CH3CH2NO2,A为
,C的俗名为甘氨酸,为CH2(NH2)COOH,同分异构体为:CH3CH2NO2,A为 ,
,
故答案为: ; C7H6O2;CH3CH2NO2.
; C7H6O2;CH3CH2NO2.
点评 本题考查有机物的推断,侧重于学生的分析、计算能力的考查,题目着重于考查有机物分子式的确定,题目难度较大,注意掌握判断有机物分子式的方法,本题中计算相对分子质量为本题的解答关键.

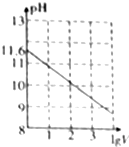 常温下,1ml 0.10mol•L-1K2CO3溶液,加水稀释至体积为Vml,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
常温下,1ml 0.10mol•L-1K2CO3溶液,加水稀释至体积为Vml,pH随lgV的变化情况如图所示,下列叙述中正确的是( )| A. | 0.10mol•L-1的K2CO3溶液中由水电离出的c(OH-)═10-11.6mol•L-1 | |
| B. | 0.10 mol•L-1的K2CO3溶液中:2c(K+)═c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 当lgV=2时,若K2CO3溶液升高温度,溶液碱性增强,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$-)减小 | |
| D. | 当lgV=3时,K2CO3溶液中:c(OH-)═c(H+)+c(HCO3-)+2c(H2CO3) |
| A. | CuO+2H+═Cu2++H2O | B. | CaCO3+2H+═Ca2++CO2↑+H2O | ||
| C. | Fe+2H+═Fe2++H2↑ | D. | Ba(OH)2+2H+═Ba2++2H2O |
| A. | 同温同压下甲烷和氧气的密度之比为2:1 | |
| B. | 等物质的量的甲烷和氧气的质量之比为2:1 | |
| C. | 1g甲烷和1g氧气的原子数之比为5:1 | |
| D. | 在标准状态下等质量的甲烷和氧气的体积比为1:1 |
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 麻黄的分子式为C10 H17O | |
| B. | 麻黄可以从植物中提取 | |
| C. | 麻黄在空气中燃烧有NO释出 | |
| D. | 麻黄的一溴代物有3种且可与HCl反应 |
