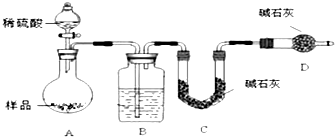
题目内容
4.向硫酸铝溶液中滴加氢氧化钾溶液过程中:(1)写出上述过程中可能发生反应的离子方程式.
(2)绘出氢氧化铝沉淀物质的量与KOH溶液体积之间的有关图象.
(3)向100mL0.5mol/L的硫酸铝溶液中加入1.5mol/L的KOH溶液多少毫升可以得到3.12克白色沉淀?(要求写出计算过程)
分析 (1)可能发生反应的离子方程式为Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O;
(2)绘出氢氧化铝沉淀物质的量与KOH溶液体积之间的有关图象为: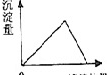 ;
;
(3)n(Al3+)=0.1L×0.5mol/L×2=0.1mol,n[Al(OH)3]=$\frac{3.12g}{78g/mol}$=0.04mol,若铝离子完全转化为沉淀,应生成沉淀0.1mol,则
①KOH不足,发生Al3++3OH-═Al(OH)3↓;
②KOH过量,发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,以此计算.
解答 解:(1)可能发生反应的离子方程式为Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,答:可能发生反应的离子方程式为Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O;
(2)绘出氢氧化铝沉淀物质的量与KOH溶液体积之间的有关图象为: ,答:图象为:
,答:图象为: ;
;
(3)n(Al3+)=0.1L×0.5mol/L×2=0.1mol,n[Al(OH)3]=$\frac{3.12g}{78g/mol}$=0.04mol,若铝离子完全转化为沉淀,应生成沉淀0.1mol,则
①KOH不足,发生Al3++3OH-═Al(OH)3↓,则
Al3++3OH-═Al(OH)3↓,
0.12mol 0.04mol
可知需要K0H溶液的体积为$\frac{0.12mol}{1.5L}$=0.08L=80mL;
②KOH过量,发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,则
Al3++3OH-═Al(OH)3↓
0.1mol 0.3mol 0.1mol
沉淀溶解了0.1mol-0.04mol=0.06mol,
Al(OH)3+OH-═AlO2-+2H2O
0.06mol 0.06mol
可知需要K0H溶液的体积为$\frac{0.3mol+0.06mol}{1.5mol/L}$=0.24L=240mL,
答:KOH溶液80mL或240mL.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及氢氧化铝的两性为解答的关键,侧重分析与计算能力的考查,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 0.5体积 | B. | 2体积 | C. | 3体积 | D. | 4.5体积 |
| A. | Cl2既是氧化剂也是还原剂 | |
| B. | 被氧化的氯原子数是被还原的氯原子数的5倍 | |
| C. | 当有11.7 g的NaCl生成时,电子转移数为0.2NA | |
| D. | NaCl是还原产物,NaClO3是氧化产物 |
| A. | 加压 | B. | 减压 | C. | 减小B的浓度 | D. | 升温 |
| A. | 在发生化学反应时,甲原子失电子数比乙原子多 | |
| B. | 甲的阳离子的氧化性比乙离子强 | |
| C. | 甲的氢氧化物的碱性小于乙的氢氧化物的碱性 | |
| D. | 在甲、乙、硫酸组成的原电池中,甲为负极 |
| A. | 1 mol Cl2与足量Fe反应,转移的电子数为3NA | |
| B. | 3mol NO2与足量H2O反应,转移的电子数为NA | |
| C. | 0.1mol/L的氢氧化钠溶液中含钠离子数为0.1NA个 | |
| D. | 0.30mol Fe粉与足量水蒸气反应生成的H2分子数为0.40NA |