题目内容
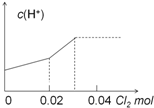
1.氯碱工业生产中用氨气检查氯气管道是否泄漏,氨气遇到氯气会产生白烟,(1)反应还生成了一种无毒的气态单质,写出反应的化学方程式3Cl2+8NH3═6NH4Cl+N2.
(2)在该反应中,氧化剂是Cl2,还原产物是NH4Cl,当有1.7g的氨气参与反应时,转移的电子数目为0.075NA.
(3)列式计算当有112mL的氯气(已折算到标准状况)参加反应时生成白烟的质量为0.535 g.
分析 (1)氨气遇到氯气会产生白烟,反应还生成了一种无毒的气态单质,这种单质是氮气;
(2)氧化还原反应中失电子的元素化合价升高,被氧化,所在反应物是还原剂,对应产物是氧化产物,得电子的元素化合价降低,所在反应物是氧化剂,对应产物是还原产物;
(3)根据Cl2~~~2NH4Cl进行计算求解.
解答 解:(1)氨气遇到氯气会产生白烟,反应还生成了一种无毒的气态单质,这种单质是氮气,反应的化学方程式为:3Cl2+8NH3═6NH4Cl+N2,故答案为:3Cl2+8NH3═6NH4Cl+N2;
(2)氯气中氯元素化合降低,是氧化剂,得到产物氯化铵是还原产物,8mol的氨气参加反应转移电子的物质的量为6mol,所以有1.7g的氨气,也就是0.1mol的氨气参与反应时,转移的电子数目为$\frac{6}{8}×0.1×{N}_{A}$,即为:0.075NA,故答案为:Cl2;NH4Cl;0.075NA;
(3)Cl2~~~2NH4Cl
22400ml 107g
112mL m
所以m=$\frac{107g×112ml}{22400ml}$=0.535g,
故答案为:0.535.
点评 本题考查学生氧化还原反应中的概念和电子转移知识以及化学方程式的计算,可以根据所学知识进行回答,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.把V L含有MgSO4和Al2(SO4)3的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使铝离子完全转化为AlO2-;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为BaSO4.则原混合溶液中Mg2+的浓度为( )
| A. | $\frac{8b-3a}{2V}$mol•L-1 | B. | $\frac{8b-3a}{V}$mol•L-1 | C. | $\frac{a-2b}{V}$mol•L-1 | D. | $\frac{a-2b}{2V}$mol•L-1 |
9.碳酸氢铵是我国主要的氮肥品种之一,在贮存和运输过程中容易挥发损失.为了鉴定其质量和确定田间施用量,必须测定其含氮量.
I.某学生设计了一套以测定二氧化碳含量间接测定含氮量的方法.将样品放入圆底烧瓶中:

(1)请选择必要地装置,按气流方向连接顺序为b-e,f-h,g-c.
(2)分液漏斗中的液体最适合的是B.
A.稀盐酸 B.稀硫酸 C.浓硝酸 D.氢氧化钠
(3)连在最后的装置起到的作用防止空气中水和二氧化碳进入装置影响实验结果.
Ⅱ.如果氮肥中成分是(NH4)2SO4,则可以用甲醛法测定含氮量.甲醛法是基于甲醛与一定量的铵盐作用,生成相当量的酸,反应为2(NH4)2SO4+6HCHO→(CH2)6N4+2H2SO4+6H2O,生成的酸再用氢氧化钠标准溶液滴定,从而测定氮的含量.步骤如下:
(4)用差量法称取固体(NH4)2SO4样品0.6g于烧杯中,加入约30mL蒸馏水溶解,最终配成100mL溶液.用酸式滴定管准确取出20.00mL的溶液于锥形瓶中,加入18%中性甲醛溶液5mL,放置5min后,加入1~2滴酚酞指示剂(已知滴定终点的pH约为8.8),用浓度为0.08mol/L氢氧化钠标准溶液滴定,读数如下表:
达滴定终点时的现象为溶液从无色变为浅红色,30s内不褪色,由此可计算出该样品中的氮的质量分数为14%.
(5)在滴定实验结束后发现滴定用的滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,则此实验测定的含氮量比实际值偏小(填“偏大”“偏小”或“无影响”).
I.某学生设计了一套以测定二氧化碳含量间接测定含氮量的方法.将样品放入圆底烧瓶中:

(1)请选择必要地装置,按气流方向连接顺序为b-e,f-h,g-c.
(2)分液漏斗中的液体最适合的是B.
A.稀盐酸 B.稀硫酸 C.浓硝酸 D.氢氧化钠
(3)连在最后的装置起到的作用防止空气中水和二氧化碳进入装置影响实验结果.
Ⅱ.如果氮肥中成分是(NH4)2SO4,则可以用甲醛法测定含氮量.甲醛法是基于甲醛与一定量的铵盐作用,生成相当量的酸,反应为2(NH4)2SO4+6HCHO→(CH2)6N4+2H2SO4+6H2O,生成的酸再用氢氧化钠标准溶液滴定,从而测定氮的含量.步骤如下:
(4)用差量法称取固体(NH4)2SO4样品0.6g于烧杯中,加入约30mL蒸馏水溶解,最终配成100mL溶液.用酸式滴定管准确取出20.00mL的溶液于锥形瓶中,加入18%中性甲醛溶液5mL,放置5min后,加入1~2滴酚酞指示剂(已知滴定终点的pH约为8.8),用浓度为0.08mol/L氢氧化钠标准溶液滴定,读数如下表:
| 滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 1.20 | 16.21 |
| 2 | 3.00 | 18.90 |
| 3 | 4.50 | 19.49 |
(5)在滴定实验结束后发现滴定用的滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,则此实验测定的含氮量比实际值偏小(填“偏大”“偏小”或“无影响”).
6.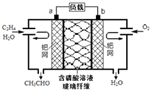 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A. | a电极发生还原反应 | |
| B. | 放电时,每转移2mol电子,理论上需要消耗28g乙烯 | |
| C. | b极反应式为:O2+4e-+2H2O═4OH- | |
| D. | 电子移动方向:电极a→磷酸溶液→电极b |
13. 在体积恒定的密闭容器中发生反应N2O4(g)?2NO2(g)△H(△H>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的是( )
在体积恒定的密闭容器中发生反应N2O4(g)?2NO2(g)△H(△H>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的是( )
 在体积恒定的密闭容器中发生反应N2O4(g)?2NO2(g)△H(△H>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的是( )
在体积恒定的密闭容器中发生反应N2O4(g)?2NO2(g)△H(△H>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的是( )| A. | A、C两点的反应速率:A>C | |
| B. | A、C两点气体的颜色:A深,C浅 | |
| C. | 由状态B到状态A,可以用加热的方法 | |
| D. | A、C两点气体的平均相对分子质量:A>C |
 下表各组物质中,满足下右图物质一步转化关系的选项是( )
下表各组物质中,满足下右图物质一步转化关系的选项是( )