题目内容
12.已知反应 Cl2+NaOH→NaCl+NaClO3+H2O(未配平),下列说法不正确的是( )| A. | Cl2既是氧化剂也是还原剂 | |
| B. | 被氧化的氯原子数是被还原的氯原子数的5倍 | |
| C. | 当有11.7 g的NaCl生成时,电子转移数为0.2NA | |
| D. | NaCl是还原产物,NaClO3是氧化产物 |
分析 反应Cl2+NaOH→NaCl+NaClO3+H2O,根据电子得失配平为:3Cl2+6NaOH=5NaCl+NaClO3+3H2O,在氧化还原反应中,得电子的反应物是氧化剂,失电子的反应物是还原剂,氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物,根据得失电子数相等判断被氧化和被还原的氯原子的个数比,由此分析解答.
解答 解:A.该反应中,氯气既得电子又失电子,所以氯气既是氧化剂 也是还原剂,故A正确;
B.该反应中,一个氯原子失去5个电子,一个氯原子得到1个电子,要使得失电子数相等,则失电子的原子个数是1,得电子的原子个数是5,所以被氧化的氯原子数是被还原的氯原子数的$\frac{1}{5}$,故B错误;
C.当有11.7 g的NaCl生成时,也就是生成0.2mol的氯化钠,生成5mol转移5mol电子,所以生成0.2mol转移电子数为0.2NA,故C正确;
D.该反应中,氯化钠是还原产物,NaClO3氧化产物,故D正确;
故选B.
点评 本题考查了氧化还原反应,注意该反应中氧化剂和还原剂都是氯气,根据得失电子数相等确定氧化剂和还原剂的质量之比,为易错点.

练习册系列答案
相关题目
9.碳酸氢铵是我国主要的氮肥品种之一,在贮存和运输过程中容易挥发损失.为了鉴定其质量和确定田间施用量,必须测定其含氮量.
I.某学生设计了一套以测定二氧化碳含量间接测定含氮量的方法.将样品放入圆底烧瓶中:
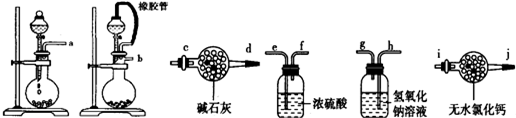
(1)请选择必要地装置,按气流方向连接顺序为b-e,f-h,g-c.
(2)分液漏斗中的液体最适合的是B.
A.稀盐酸 B.稀硫酸 C.浓硝酸 D.氢氧化钠
(3)连在最后的装置起到的作用防止空气中水和二氧化碳进入装置影响实验结果.
Ⅱ.如果氮肥中成分是(NH4)2SO4,则可以用甲醛法测定含氮量.甲醛法是基于甲醛与一定量的铵盐作用,生成相当量的酸,反应为2(NH4)2SO4+6HCHO→(CH2)6N4+2H2SO4+6H2O,生成的酸再用氢氧化钠标准溶液滴定,从而测定氮的含量.步骤如下:
(4)用差量法称取固体(NH4)2SO4样品0.6g于烧杯中,加入约30mL蒸馏水溶解,最终配成100mL溶液.用酸式滴定管准确取出20.00mL的溶液于锥形瓶中,加入18%中性甲醛溶液5mL,放置5min后,加入1~2滴酚酞指示剂(已知滴定终点的pH约为8.8),用浓度为0.08mol/L氢氧化钠标准溶液滴定,读数如下表:
达滴定终点时的现象为溶液从无色变为浅红色,30s内不褪色,由此可计算出该样品中的氮的质量分数为14%.
(5)在滴定实验结束后发现滴定用的滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,则此实验测定的含氮量比实际值偏小(填“偏大”“偏小”或“无影响”).
I.某学生设计了一套以测定二氧化碳含量间接测定含氮量的方法.将样品放入圆底烧瓶中:

(1)请选择必要地装置,按气流方向连接顺序为b-e,f-h,g-c.
(2)分液漏斗中的液体最适合的是B.
A.稀盐酸 B.稀硫酸 C.浓硝酸 D.氢氧化钠
(3)连在最后的装置起到的作用防止空气中水和二氧化碳进入装置影响实验结果.
Ⅱ.如果氮肥中成分是(NH4)2SO4,则可以用甲醛法测定含氮量.甲醛法是基于甲醛与一定量的铵盐作用,生成相当量的酸,反应为2(NH4)2SO4+6HCHO→(CH2)6N4+2H2SO4+6H2O,生成的酸再用氢氧化钠标准溶液滴定,从而测定氮的含量.步骤如下:
(4)用差量法称取固体(NH4)2SO4样品0.6g于烧杯中,加入约30mL蒸馏水溶解,最终配成100mL溶液.用酸式滴定管准确取出20.00mL的溶液于锥形瓶中,加入18%中性甲醛溶液5mL,放置5min后,加入1~2滴酚酞指示剂(已知滴定终点的pH约为8.8),用浓度为0.08mol/L氢氧化钠标准溶液滴定,读数如下表:
| 滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 1.20 | 16.21 |
| 2 | 3.00 | 18.90 |
| 3 | 4.50 | 19.49 |
(5)在滴定实验结束后发现滴定用的滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,则此实验测定的含氮量比实际值偏小(填“偏大”“偏小”或“无影响”).
7.下列离子在溶液中能大量共存的是( )
| A. | Na+、CO32-、SO42-、H+ | B. | K+、AlO2-、H+、Cl- | ||
| C. | Fe3+、K+、OH-、NO3- | D. | Al3+、H+、NO3-、SO42- |
7.①钠比水轻;②钠的熔点较低;③钠与水反应时要放出热量;④钠与水反应后溶液呈碱性.某学生将一小块金属钠投入滴有酚酞试液的水中,该实验能证明上述四点性质中的( )
| A. | ①④ | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
17.下列说法不正确的是( )
| A. | 在干旱地区植树造林时,可利用高吸水性树脂抗旱保水 | |
| B. | 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 | |
| C. | 在食用盐中加入碘单质制得的加碘盐.可用于预防大脖子病 | |
| D. | 服用阿司匹林若出现水杨酸反应,应立即停药并静脉滴注NaHCO3溶液 |
1.下列说法正确的是( )
| A. | 在101kPa时,1molS完全燃烧生成SO3时所放出的热量,是S的燃烧热 | |
| B. | 吸热反应必须加热才能反应,放热反应不需要加热 | |
| C. | 在101kPa时,1mol S和2mol S的燃烧热相同 | |
| D. | 在稀溶液中,H2SO4和Ba(OH)2完全中和产生1mol水时放出的热量为57.3kJ |