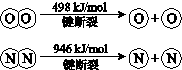
题目内容
5.把硫和强碱(如NaOH)加热至沸,反应后,硫转化为S2-和SO32-,则反应的S和生成的S2-、SO32-的物质的量之比为( )| A. | 2:1:1 | B. | 3:2:1 | C. | 3:1:2 | D. | 4:1:3 |
分析 根据原子守恒:反应的S的物质的量和生成的S2-、SO32-的物质的量之和相等,根据电子守恒结合原子守恒计算.
解答 解:设:反应的S和生成的S2-、SO32-的物质的量分别是x、y、z,则x=y+z,2y=4z,所以X:y:z=3:2:1,故选B.
点评 本题考查学生元素守恒和电子守恒的应用知识,注意氧化还原反应中电子守恒的灵活应用是关键,难度不大.

练习册系列答案
相关题目
16.根据有机化合物的命名原则,下列命名正确的是( )
| A. | 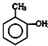 甲基苯酚 甲基苯酚 | |
| B. | 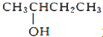 2-羟基丁烷 2-羟基丁烷 | |
| C. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | |
| D. | CH2=CH-CH=CH-CH=CH2 1,3,5-己三烯 |
20.下列物质中,属于电解质的有( )
| A. | 乙酸 | B. | 乙醇 | C. | 油脂 | D. | 氯化钠 |
17.地壳中硅元素的主要存在形式是( )
| A. | 二氧化硅 硅酸盐 | B. | 四氯化硅 硅酸 | ||
| C. | 碳化硅 硅酸钠 | D. | 硅 硅酸盐 |
14.已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol,Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO的燃烧热为566 kJ/mol | |
| B. | 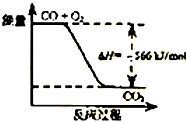 如图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| D. | CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为4NA |
 ;
; .
. ;
; .
. →
→ ;
;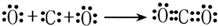 .
. 自然界中氮元素有多种存在形式
自然界中氮元素有多种存在形式