题目内容
17.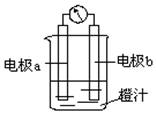 利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品和如图装置,探究原电池的原理.下列结论错误的是( )
利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品和如图装置,探究原电池的原理.下列结论错误的是( )| A. | a为镁条、b为锌片时,镁条为负极 | |
| B. | a为镁条、b为锌片时,橙汁中阳离子移向b电极 | |
| C. | a为锌片、b为铜片时,铜极上发生还原反应 | |
| D. | a为锌片、b为铜片时,电子由铜片通过导线流向锌片 |
分析 金属活泼性镁>锌>铜,a为镁条、b为锌片时,镁为负极,锌为正极,a为锌片、b为铜片时,锌为负极,铜为正极,原电池工作时,负极发生氧化反应,正极发生还原反应,电子从负极经外电路流向正极,以此解答该题.
解答 解:A.镁比锌活泼,a为镁条、b为锌片时,镁条为负极,故A正确;
B.a为镁条、b为锌片时,形成原电池反应,镁为负极,锌为正极,橙汁中阳离子移向正极b电极,故B正确;
C.a为锌片、b为铜片时,锌为负极,铜为正极,原电池工作时,铜极即正极发生还原反应,故C正确;
D.a为锌片、b为铜片时,锌为负极,铜为正极,电子由负极锌片通过导线流向正极铜片,故D错误.
故选D.
点评 本题考查原电池知识,为高考高频考点,侧重于学生的分析能力的考查,注意把握原电池的组成以及工作原理,能正确书写电极方程式,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
18.下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
| B | 向稀硝酸中加入少量铁粉 | 有气泡产生 | 说明Fe置换出硝酸中的氢,生成了氢气 |
| C | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | 出现白色胶状物质 | H2CO3的酸性比H2SiO3的酸性强 |
| D | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | NaHCO3为难溶物 |
| A. | A | B. | B | C. | C | D. | D |
5.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,16 g O3中含有的原子数为NA | |
| B. | 标准状况下,22.4 L H2O中含有的分子数为NA | |
| C. | 1 mol Na在空气中完全燃烧转移的电子数为2NA | |
| D. | 1 L 1 mol•L-1 CaCl2溶液中含有的氯离子数为NA |
12.某有机物Z具有较广泛的抗菌作用,其生成机理可由X与Y相互作用:
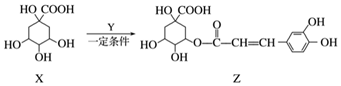
下列有关叙述中不正确的是( )

下列有关叙述中不正确的是( )
| A. | Z结构中有1个手性碳原子 | |
| B. | Y的分子式为C9H8O4 | |
| C. | 1 mol Z与足量NaOH溶液反应,最多消耗8 mol NaOH | |
| D. | Z与浓溴水既能发生取代反应又能发生加成反应 |
2.中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖. 关于青蒿素和双氢青蒿素(结构如图)的下列说法中错误的是( )


| A. | 双氢青蒿素的分子式为 C15H24O5 | |
| B. | 双氢青蒿素分子中有2个六元环和2个七元环 | |
| C. | 青蒿素分子中含有过氧键、酯基和醚键 | |
| D. | 由青蒿素制备双氢青蒿素的反应属于还原反应 |
6.一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+B(g)?2C(g)+D(s)已达到平衡状态的是( )
①混合气体的压强
②混合气体的密度
③B的物质的量浓度
④混合气体总物质的量
⑤混合气体的平均相对分子质量
⑥混合气体的总质量
⑦混合气体的总体积.
①混合气体的压强
②混合气体的密度
③B的物质的量浓度
④混合气体总物质的量
⑤混合气体的平均相对分子质量
⑥混合气体的总质量
⑦混合气体的总体积.
| A. | ②③⑤⑥ | B. | ①②③⑤⑥ | C. | ①②③⑤⑦ | D. | ②③④⑤ |
7.下列转化需要加入氧化剂才能实现的是( )
| A. | H2S SO2 | B. | H2SO4 SO2 | C. | SO2 SO32- | D. | SO32- SO2 |