题目内容
已知298K时,合成氨反应N2(g)+3H2(g)═2NH3(g)△H=-92.0kJ?mol-1,将此温度下的1mol N2和3mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(假定测量过程中没有能量损失)( )
| A、一定大于92.0 kJ |
| B、无法确定 |
| C、一定小于92.0 kJ/mol |
| D、一定小于92.0 kJ |
考点:反应热和焓变
专题:
分析:合成氨是可逆反应,反应物不能完全转化,热化学方程式中的焓变是生成物与反应物的能量差,据此分析.
解答:
解:合成氨是可逆反应,反应物不能完全转化,热化学方程式中的焓变是生成物与反应物的能量差,1mol N2和3mol H2不能所以完全转化为氨气,所以放热少于92KJ,故选D.
点评:本题考查了可逆反应的反应热,题目难度不大.

练习册系列答案
相关题目
在做中和热实验测定中和热时,应使用的仪器正确的组合是:( )
①量筒 ②托盘天平 ③烧杯 ④容量瓶 ⑤冷凝管 ⑥温度计 ⑦酒精灯.
①量筒 ②托盘天平 ③烧杯 ④容量瓶 ⑤冷凝管 ⑥温度计 ⑦酒精灯.
| A、①③⑥ | B、②③⑤ |
| C、①②③⑥ | D、全部 |
化学反应N2+3H2→2NH3的能量变化如图所示,该反应的热化学方程式是( )

A、
| ||||
B、
| ||||
| C、N2(g)+3 H2(g)→2 NH3(g);△H=2(b-a)kJ/mol | ||||
| D、N2(g)+3 H2(g)→2 NH3(1);)△H=2(a-b-c)kJ/mol |
在工业生产中,降低能耗是重要的节能措施.下列说法不符合生产实际的是( )
| A、使用恰当的还原剂,可以在较低的温度下把金属从矿石中提取出来 |
| B、研制出性能优良的催化剂可以使反应温度降低,提高反应速率,从而起到节能效果 |
| C、制水泥、玻璃等硅酸盐工业需要消耗大量能源,我们应通过降低其产量来节能 |
| D、利用铝的还原性和铝转化为氧化铝时能放出大量热的性质,工业上常用铝粉来还原一些金属氧化物 |
下列反应中属于加成反应的是( )
A、CH4+Cl2
| |||
| B、CH2=CH2+Br2→CH2BrCH2Br | |||
C、2CH3CH2OH+O2
| |||
D、 |
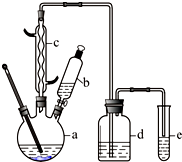 溴苯是一种化工原料,某兴趣小组用如下装置制备溴苯并证明苯和液溴发生的是取代反应,而不是加成反应.有关数据如下:
溴苯是一种化工原料,某兴趣小组用如下装置制备溴苯并证明苯和液溴发生的是取代反应,而不是加成反应.有关数据如下: