题目内容
(1)国际上规定, 所含的碳原子数叫做阿伏加德罗常数.
(2)酸、碱、盐在水溶液中发生的离子反应的条件是生成 ,只要具备上述条件之一,反应就能发生.
(3)在氧化还原反应中,元素化合价发生变化的实质是有 ;元素化合价升高,该物质发生 反应.
(2)酸、碱、盐在水溶液中发生的离子反应的条件是生成
(3)在氧化还原反应中,元素化合价发生变化的实质是有
考点:离子反应发生的条件,氧化还原反应
专题:
分析:(1)根据阿伏加德罗常数的规定回答;
(2)酸、碱、盐之间的反应为复分解反应;
(3)化合价变化的本质是电子转移;如果反应前后元素化合价发生变化,反应为氧化还原反应.
(2)酸、碱、盐之间的反应为复分解反应;
(3)化合价变化的本质是电子转移;如果反应前后元素化合价发生变化,反应为氧化还原反应.
解答:
解:(1)0.012kg12C所含碳原子数为阿伏加德罗常数,故答案为:0.012kg12C;
(2)酸、碱、盐之间的反应为复分解反应,反应发生的条件为具备生成沉淀、气体或弱电解质三者之一即可发生,
故答案为:沉淀、气体或弱电解质;
(3)化合价变化的本质是电子转移;反应前后元素化合价发生变化的反应为氧化还原反应,元素化合价升高,该物质发生氧化反应,
故答案为:电子转移;氧化.
(2)酸、碱、盐之间的反应为复分解反应,反应发生的条件为具备生成沉淀、气体或弱电解质三者之一即可发生,
故答案为:沉淀、气体或弱电解质;
(3)化合价变化的本质是电子转移;反应前后元素化合价发生变化的反应为氧化还原反应,元素化合价升高,该物质发生氧化反应,
故答案为:电子转移;氧化.
点评:考查学生对基础知识的掌握,以识记为主,难度较小,根据所学解答.

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
已知298K时,合成氨反应N2(g)+3H2(g)═2NH3(g)△H=-92.0kJ?mol-1,将此温度下的1mol N2和3mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(假定测量过程中没有能量损失)( )
| A、一定大于92.0 kJ |
| B、无法确定 |
| C、一定小于92.0 kJ/mol |
| D、一定小于92.0 kJ |
下列有关原子结构及元素周期律的叙述不正确的是( )
| A、原子半径:Na>O;离子半径:Na+<O2- |
| B、第ⅦA族元素碘的两种核素131I和137I的核外电子数之差为6 |
| C、P和As属于第VA族元素,H3PO4的酸性强于H3AsO4的酸性 |
| D、Na、Mg、Al三种元素最高价氧化物对应水化物的碱性均依次减弱 |
下列溶液中各微粒的浓度关系一定正确的是( )
| A、25°C时,pH=10的CH3COONa溶液与pH=10的氨水中,c(OH-)之此为1:1 |
| B、在Na2CO3和NaHCO3的混合溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-) |
| C、浓度相同的①CH3COONa②NaNO3③Na2CO3④NaOH四种溶液,pH的大小顺序是:④>③>②>① |
| D、只含NH4+、Cl-、H+、OH-四种离子的酸性溶液中,一定存在:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
在进行蒸馏操作中,加热一段时间后,发现碎瓷片忘加,应采取的正确操作是( )
| A、立即补加 | B、冷却后补加 |
| C、不需补加 | D、重新配料 |
有关如图及实验的描述不正确的是( )
A、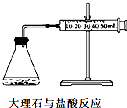 可以测量大理石与盐酸的反应速率 |
B、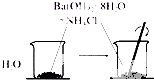 说明吸热反应也可能是自发反应 |
C、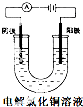 两个电极都为铜片时,电解初期溶液的浓度基本不改变 |
D、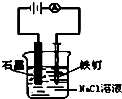 实验中,铁钉上会有刺激性气体产生 |
下列离子方程式正确的是( )
| A、向AlCl3溶液滴入过量氨水:Al3++4OH-=AlO2-+2H2O | ||
B、用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-
| ||
| C、苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | ||
| D、Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+4H++2MnO4-=5SO42-+2Mn2++2H2O |
化学与生活密切相关,下列有关说法不正确的是( )
| A、陶瓷是人类应用很早的硅酸盐材料 |
| B、对海洋资源开发可获得Fe、Co、K、Au、Mg、B、I等金属 |
| C、氮的固定不定都要在高温、高压、催化剂的条件下才能实现 |
| D、控制工业废水和生活污水的排放可以有效地防止水体污染,改善水质 |
 乙醇的催化氧化,看右图答出实验现象.
乙醇的催化氧化,看右图答出实验现象.