题目内容
ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液.为测定所得溶液中ClO2的含量,进行下列实验:准确量取ClO2溶液10mL,稀释成100mL试样;量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定至终点,反应原理:2Na2S2O3+I2→Na2S4O6+2NaI,消耗Na2S2O3溶液V2mL.
(1)滴定过程中至少须进行两次平行测定的原因是 .
(2)到达滴定终点时指示剂的颜色变化为 .
(3)原ClO2溶液的浓度为 g/L(用含字母的代数式表示).
(1)滴定过程中至少须进行两次平行测定的原因是
(2)到达滴定终点时指示剂的颜色变化为
(3)原ClO2溶液的浓度为
考点:氯、溴、碘及其化合物的综合应用
专题:卤族元素
分析:(1)化学实验多次实验可以减少误差;
(2)根据反应原理,滴定终点时,I2完全反应,溶液由蓝色变为无色;
(3)根据元素守恒结合反应得到关系式2ClO2~5I2~10Na2S2O3计算c(ClO2).
(2)根据反应原理,滴定终点时,I2完全反应,溶液由蓝色变为无色;
(3)根据元素守恒结合反应得到关系式2ClO2~5I2~10Na2S2O3计算c(ClO2).
解答:
解:(1)为减少实验误差,应采用多次实验的方法,取平均值,故答案为:减少偶然误差;
(5)滴定终点时,I2完全反应,溶液由蓝色变为无色,故答案为:蓝色变为无色;
(6)二氧化硫和碘单质的反应中,根据电子守恒,得到:2ClO2~5I2,结合反应2Na2S2O3+I2=Na2S4O6+2NaI,得到关系式:2ClO2~5I2~10Na2S2O3.
设原ClO2溶液的浓度为x,
2ClO2~5I2~10Na2S2O3
2mol 10mol
1×10-3cV2mol
x=
mol/L=
g/L,
故答案为:
.
(5)滴定终点时,I2完全反应,溶液由蓝色变为无色,故答案为:蓝色变为无色;
(6)二氧化硫和碘单质的反应中,根据电子守恒,得到:2ClO2~5I2,结合反应2Na2S2O3+I2=Na2S4O6+2NaI,得到关系式:2ClO2~5I2~10Na2S2O3.
设原ClO2溶液的浓度为x,
2ClO2~5I2~10Na2S2O3
2mol 10mol
| 10-2xV1×10-3 |
| 10-1 |
x=
| 2cV2 |
| V1 |
| 135c2V2 |
| V1 |
故答案为:
| 135c2V2 |
| V1 |
点评:本题考查实验方案的设计,同时考查学生分析问题、解决问题的能力,明确物质的性质是解本题关键,难度较大.

练习册系列答案
相关题目
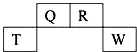 如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法不正确的是( )
如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法不正确的是( )| A、气态氢化物稳定性:R>Q |
| B、Q与W可形成直线型分子QW2 |
| C、同主族气态氢化物中R的氢化物最稳定,因其分子间存在氢键 |
| D、原子半径:T>W,简单离子半径:T<W |
下列说法正确的是( )
| A、难溶电解质作比较时,Ksp小的,溶解度一定小 |
| B、Ksp大小取决于难溶电解质的量,所以离子浓度改变时,沉淀平衡会发生移动 |
| C、所谓沉淀完全就是用沉淀剂将溶液中某一离子完全除去 |
| D、温度一定,当溶液中Ag+ 和Cl-浓度的乘积等于Ksp时,溶液为AgCl的饱和溶液 |
下列有关化学实验基本知识和基本操作的描述不正确的是( )
| A、丁达尔效应可以用于区别FeCl3溶液和Fe(OH)3胶体 |
| B、加入足量浓 NaOH溶液,产生了带有强烈刺激性气味的气体.溶液中一定含有大量的NH4?+ |
| C、加入盐酸,能产生使澄清石灰水变浑浊的气体,则溶液中一定含有CO3 2- |
| D、先加入BaCl2溶液,再加入HNO3溶液,产生了白色沉淀,则溶液中一定含有大量的SO42- |
已知298K时,合成氨反应N2(g)+3H2(g)═2NH3(g)△H=-92.0kJ?mol-1,将此温度下的1mol N2和3mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(假定测量过程中没有能量损失)( )
| A、一定大于92.0 kJ |
| B、无法确定 |
| C、一定小于92.0 kJ/mol |
| D、一定小于92.0 kJ |
下列说法正确的是( )
| A、向500mL 1 mol/LNa2CO3溶液中,滴加600mL 1 mol/LHCl 得到标况下CO2体积为2.24L |
| B、电解精炼铜时,若阴极得到2摩尔电子,则阳极质量减少64克 |
| C、将208 g BaCl2固体溶解在1 L水中,形成的溶液的浓度为1 mol?L-1 |
| D、可用pH试纸测得氯水的酸性强弱 |
下列溶液中各微粒的浓度关系一定正确的是( )
| A、25°C时,pH=10的CH3COONa溶液与pH=10的氨水中,c(OH-)之此为1:1 |
| B、在Na2CO3和NaHCO3的混合溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-) |
| C、浓度相同的①CH3COONa②NaNO3③Na2CO3④NaOH四种溶液,pH的大小顺序是:④>③>②>① |
| D、只含NH4+、Cl-、H+、OH-四种离子的酸性溶液中,一定存在:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
有关下列高分子材料叙述正确的是( )
| A、塑料是以石油、天然气为原料,以二烯烃和烯烃为单体聚合成的高分子 |
| B、光导纤维是一种能高质量传导光的玻璃纤维,属于具有特殊性能的合成纤维 |
| C、塑料制品在土壤中容易被微生物分解,所以废弃塑料制品不会对环境造成严重的污染 |
| D、工程塑料具有某些优异的性能,可作为工程材料代替某些金属 |