题目内容
15.下列选项中,对于指定项目的数目前后相等的是( )| A. | 电子数:17gOH-与1mol-OH | |
| B. | 双键数目:1mol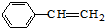 与4mol C2H4 与4mol C2H4 | |
| C. | 分子数:常温常压下16g氧气与4g氦气 | |
| D. | 阴离子总数:72gCaO2与62g Na2O |
分析 A.氢氧根离子含有10个电子,而-OH含有9个电子;
B.苯乙烯分子与乙烯分子均含有1个碳碳双键;
C.根据n=$\frac{m}{M}$计算气体物质的量,分子数目之比等于其物质的量之比;
D..根据n=$\frac{m}{M}$计算物质的量,1molCaO2含有1mol过氧根离子,1molNa2O含有1mol氧离子.
解答 解:A.17gOH-的物质的量为1mol,含有10mol电子,而1mol-OH含有9mol电子,含有电子数目不相等,故A错误;
B.1mol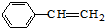 含有1mol碳碳双键,4mol C2H4含有4mol碳碳双键,含有双键数目不相等,故B错误;
含有1mol碳碳双键,4mol C2H4含有4mol碳碳双键,含有双键数目不相等,故B错误;
C.16g氧气物质的量为$\frac{16g}{32g/mol}$=0.5mol,4g氦气物质的量为1mol,含有分子数目不相等,故C错误;
D.72gCaO2物质的量为1mol,62g Na2O物质的量为1mol,均含有1mol阴离子,故D正确,
故选:D.
点评 本题考查物质的量有关计算、物质组成等,注意氢氧根离子与羟基的区别,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.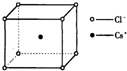 如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,则氯化铯晶体的密度为d g•cm-3,阿伏加德罗常数的值可表示为( )
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,则氯化铯晶体的密度为d g•cm-3,阿伏加德罗常数的值可表示为( )
 如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,则氯化铯晶体的密度为d g•cm-3,阿伏加德罗常数的值可表示为( )
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,则氯化铯晶体的密度为d g•cm-3,阿伏加德罗常数的值可表示为( )| A. | 2Ma3d | B. | M/(a3d) | C. | M/(2a3d) | D. | 2M/(a3d) |
6.分枝酸可用于生化研究,其结构简式为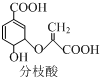 ,下列关于分枝酸的说法不正确的是( )
,下列关于分枝酸的说法不正确的是( )
 ,下列关于分枝酸的说法不正确的是( )
,下列关于分枝酸的说法不正确的是( )| A. | 分子中含有3种含氧官能团 | |
| B. | 1 mol分枝酸最多可与3mol NaOH发生中和反应 | |
| C. | 在一定条件下可与乙醇、乙酸反应,且反应类型相同 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,但褪色原理不同 |
10.下列溶液中的Cl-物质的量与100ml 1mol/L AlCl3溶液中Cl-物质的量相等的是( )
| A. | 150ml 1mol/LNaCl溶液 | B. | 100ml 3mol/L KClO3溶液 | ||
| C. | 75ml 2mol/L MgCl2溶液 | D. | 50ml 1mol/L FeCl3溶液 |
20.在一定条件下,氯气与碘单质以等物质的量进行反应,可得到一种红棕色液体ICl,ICl有很强的氧化性,ICl跟Zn、H2O反应的化学方程式如下:2ICl+2Zn═ZnCl2+ZnI2 ICl+H2O═HCl+HIO
下列关于ICl性质的叙述正确的是( )
下列关于ICl性质的叙述正确的是( )
| A. | ZnCl2是氧化产物,又是还原产物 | |
| B. | ZnI2是氧化产物,又是还原产物 | |
| C. | ICl跟H2O的反应,ICl是氧化剂,H2O是还原剂 | |
| D. | ICl跟H2O的反应,是自身氧化还原反应 |
7.不能用来鉴别Na2CO3与NaHCO3两种白色固体的实验操作是( )
| A. | 分别加热,观察有无气体生成 | |
| B. | 制成稀溶液,再分别滴加同浓度的稀盐酸 | |
| C. | 制成稀溶液,分别加入CaCl2溶液 | |
| D. | 制成溶液,分别加入少量澄清的石灰水 |
5.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 18 g D2O和18 g H2O中含有的质子数均为10NA | |
| B. | 标况下,22.4L单质溴所含有的原子数目为2NA | |
| C. | 2L 0.5 mol/L硫酸溶液中含有氢原子数目为2NA | |
| D. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA |
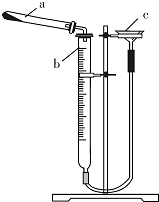 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.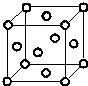 Q、R、X、Y、Z、W为周期表中原子序数依次递增的前四周期元素.
Q、R、X、Y、Z、W为周期表中原子序数依次递增的前四周期元素.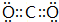 ,分子的空间构型是直线形;Z3+的原子结构示意图为
,分子的空间构型是直线形;Z3+的原子结构示意图为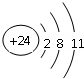 ;X2Q4分子中X原子的杂化方式为sp3杂化.
;X2Q4分子中X原子的杂化方式为sp3杂化. ,m g该物质完全燃烧后通过足量Na2O2固体充分吸收,Na2O2固体增重的质量为$\frac{15m}{23}$g
,m g该物质完全燃烧后通过足量Na2O2固体充分吸收,Na2O2固体增重的质量为$\frac{15m}{23}$g