题目内容
13.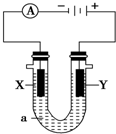 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:(1)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是纯铜,电极反应式为Cu2++2e-═Cu.
②Y电极的材料是粗铜,电极反应式为Cu-2e-═Cu2+.
(说明:杂质发生的电极反应不必写出)
(2)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为2H++2e-═H2↑.在X极附近观察到的现象是有气泡,溶液变红.
②Y电极上的电极反应式为2Cl--2e-═Cl2↑,检验该电极反应产物的方法是把湿润的淀粉KI试纸放在Y极附近,试纸变蓝,说明Y极产物为Cl2.
③如直流电源使用的是氢氧燃料电池(电解质溶液为氢氧化钾溶液),则:
正极电极反应式为2H2+4OHˉ-4eˉ═4H20
负极电极反应式为O2+2H2O+4eˉ═4OHˉ.
分析 (1)根据电解精炼铜的工作原理知识来回答;
(2)电解饱和食盐水时,由电源可知,X为阴极,Y为阳极,阳极上是氯离子失电子,阴极上是氢离子得电子;燃料电池中,燃料为负极,氧气为正极.
解答 解(1)①电解方法精炼粗铜,电解池的阴极材料是纯铜,电极反应为:Cu2++2e-=Cu,故答案为:纯铜;Cu2++2e-=Cu;
②电解方法精炼粗铜,电解池的阳极材料是粗铜,电极反应为:Cu-2e-=Cu2+,故答案为:粗铜;Cu-2e-=Cu2+;
(2)若X、Y都是惰性电极,a是饱和NaCl溶液,a为阴极,
①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,有气泡产生,附近溶液氢氧根离子浓度增大,碱性增强,溶液变红,故答案为:2H++2e-=H2↑;有气泡,溶液变红;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,检验该电极反应产物的方法是把湿润的淀粉KI试纸放在Y极附近,试纸变蓝,说明Y极产物为Cl2,
故答案为:2Cl--2e-=Cl2↑;把湿润的淀粉KI试纸放在Y极附近,试纸变蓝,说明Y极产物为Cl2;
③如直流电源使用的是氢氧燃料电池(电解质溶液为氢氧化钾溶液),正极氧气得电子发生还原反应,2H2+4OH--4e-═4H2O;负极氢气失去电子发生氧化反应,O2+2H2O+4e-═4OH-,
故答案为:2H2+4OH--4e-═4H2O;O2+2H2O+4e-═4OH-.
点评 本题考查学生电解池的工作原理知识,明确图中电源的正负极确定电解池的阴阳极是解答的关键,并熟悉电极反应及离子的放电顺序来解答,题目难度中等.

练习册系列答案
 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
3.某高聚物的结构如图所示,下列说法正确的是( )


| A. | 该高聚物为加聚产物 | B. | 该高分子为体型高分子 | ||
| C. | 该高分子的单体有6种 | D. | 该高分子中含有酯基 |
4.用R代表短周期元素,R最外层的2p能级上的未成对电子有3个,下列关于R的描述正确的是( )
| A. | R的氧化物一定能溶于水 | |
| B. | R的最高价氧化物对应水化物是H2RO3 | |
| C. | R的氢化物的水溶液呈碱性 | |
| D. | R的氧化物都能与NaOH反应 |
1.化学与生活息息相关,下列说法错误的是( )
| A. | 乙烯可作为水果的催熟剂 | |
| B. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| C. | 淀粉、纤维素、聚乙烯、油脂、蛋白质都是高分子化合物 | |
| D. | 人们使用的装饰材料、内墙涂料释放出的甲醛是居室空气污染的主要来源之一 |
8.下列叙述中,不正确的是( )
| A. | 39K+和40Ca2+微粒中的电子数和中子数都相等 | |
| B. | D2和He在同温同压时,若体积相等,则质量相等 | |
| C. | 同一元素的各种同位素的物理性质、化学性质均不相同 | |
| D. | 两个质量数和电子数都相等的微粒不一定是同种元素 |
18.下列有关实验装置进行的相应实验,不能达到实验目的是( )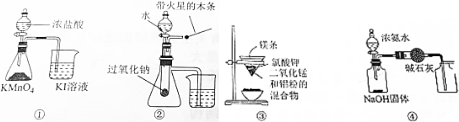

| A. | 用图①装置比较KMnO4、Cl2、I2的氧化性强弱 | |
| B. | 用图②装置验证过氧化钠与水反应既生成氧气又放热 | |
| C. | 用图③装置可制得金属锰 | |
| D. | 用图④装置制取并收集干燥纯净的NH3 |
5.下列措施中使得氨水的电离平衡向正方向移动的是( )
| A. | 加入氯化铵晶体 | B. | 加入氢氧化钠溶液 | ||
| C. | 加入硫酸溶液 | D. | 加入氯化钾晶体 |
6. 某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.
某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.
(1)该反应的离子方程式:2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O.
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
(3)在完成探究催化剂对该反应速率影响的实验时发现,未加催化剂的情况下,刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.
针对上述实验现象,同学认为高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快,从影响化学反应速率的因素看,你猜想还可能是生成的Mn2+催化反应的进行.若用实验证明你的猜想.除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是B.
A.硫酸钾 B.硫酸锰 C.二氧化锰 D.水
(4)可以利用酸性高锰酸钾测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数.该小组称量2.68g草酸钠样品溶于稀硫酸中,然后用0.2000mol•L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应 ).
①滴定前是否要滴加指示剂?否(填“是”或“否”),当溶液由无色变为紫红色,且在半分钟内不褪色,说明滴定达到终点.
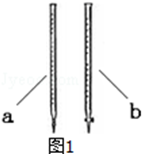
②滴定时用b(填a或b )滴定管盛装KMnO4标准溶液.
③达到终点时消耗了15.00mL的高锰酸钾溶液,样品中草酸钠的质量分数为37.5%.
 某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.
某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.(1)该反应的离子方程式:2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O.
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | ||||
| ③ | ||||
| ④ |
针对上述实验现象,同学认为高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快,从影响化学反应速率的因素看,你猜想还可能是生成的Mn2+催化反应的进行.若用实验证明你的猜想.除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是B.
A.硫酸钾 B.硫酸锰 C.二氧化锰 D.水
(4)可以利用酸性高锰酸钾测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数.该小组称量2.68g草酸钠样品溶于稀硫酸中,然后用0.2000mol•L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应 ).
①滴定前是否要滴加指示剂?否(填“是”或“否”),当溶液由无色变为紫红色,且在半分钟内不褪色,说明滴定达到终点.
②滴定时用b(填a或b )滴定管盛装KMnO4标准溶液.
③达到终点时消耗了15.00mL的高锰酸钾溶液,样品中草酸钠的质量分数为37.5%.
7.针对实验室制取氨气,下列说法不正确的是( )
| A. | 发生装置与氯酸钾制取氧气相同 | |
| B. | 可以用碱石灰干燥氨气 | |
| C. | 棉花的作用和高锰酸钾制取氧气一样 | |
| D. | 氨气验满的方法是将湿润的红色石蕊试纸放于集气瓶附近 |