题目内容
6. 某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.
某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.(1)该反应的离子方程式:2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O.
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | ||||
| ③ | ||||
| ④ |
针对上述实验现象,同学认为高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快,从影响化学反应速率的因素看,你猜想还可能是生成的Mn2+催化反应的进行.若用实验证明你的猜想.除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是B.
A.硫酸钾 B.硫酸锰 C.二氧化锰 D.水
(4)可以利用酸性高锰酸钾测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数.该小组称量2.68g草酸钠样品溶于稀硫酸中,然后用0.2000mol•L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应 ).
①滴定前是否要滴加指示剂?否(填“是”或“否”),当溶液由无色变为紫红色,且在半分钟内不褪色,说明滴定达到终点.
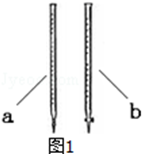
②滴定时用b(填a或b )滴定管盛装KMnO4标准溶液.
③达到终点时消耗了15.00mL的高锰酸钾溶液,样品中草酸钠的质量分数为37.5%.
分析 (1)该反应中Mn元素化合价由+7价变为+2价,C元素化合价由+3价变为+4价(MnO4-→Mn2+,H2C2O4→CO2),根据转移电子守恒、原子守恒、电荷守恒写出离子方程式;
(2)根据实验的目的和影响化学反应速率的因素来设计实验;
(3)根据反应开始锰离子浓度较小,反应过程中锰离子浓度逐渐增大分析;选择含有锰离子的试剂进行验证;
(4)①根据酸性高锰酸钾溶液为紫红色,过程中不需要加指示剂;
②根据酸性高锰酸钾溶液具有强氧化性;
③在酸性条件下,高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,根据反应计算.
解答 解:(1)该反应中Mn元素化合价由+7价变为+2价,MnO4-→Mn2+,H2C2O4是弱酸,不能拆,其中C元素化合价由+3价变为+4价,H2C2O4→CO2,其转移电子总数为10,根据转移电子守恒知,MnO4-的计量数是2、H2C2O4的计量数是5,再根据电荷守恒、原子守恒得离子方程式为:2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O,
故答案为:2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O;
(2)由实验目的可知,探究浓度、温度、接触面积对化学反应速率的影响,则实验①②的温度、催化剂的用量相同,只有浓度不同;实验①③中只有温度不同,其他条件相同;实验①④中只有催化剂的用量不同,其他条件相同,故答案为:
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | 298 | 0.5 | 0.001 | |
| ③ | 323 | 0.5 | 0.01 | |
| ④ | 298 | 0 | 0.01 |
故答案为:生成的Mn2+催化反应的进行;B;
(4)①酸性高锰酸钾溶液为紫红色,当达到滴定终点时,再滴入酸性高锰酸钾溶液时,溶液由无色变为紫红色,且在半分钟内不褪色,
故答案为:否;由无色变为紫红色,且在半分钟内不褪色;
②酸性高锰酸钾溶液具有强氧化性,腐蚀橡皮管,应用酸式滴定管,
故答案为:B;
③草酸钠(Na2C2O4)溶于稀硫酸中,然后用酸性高锰酸钾溶液进行滴定,消耗n(KMnO4)=0.015L×0.200mol•L-1=3×10-3mol,
离子方程式为:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O,则
2MnO4-~5C2O42-
2 5
3×10-3mol 7.5×10-3mol
样品中草酸钠的质量为m=7.5×10-3mol×134g/mol=7.5×134×10-3g,
样品中草酸钠的质量分数为$\frac{7.5×134×1{0}^{-3}g}{2.68g}$×100%=37.5%,
故答案为:37.5%.
点评 本题主要结合实验考查了外界条件对化学反应速率的影响,培养了学生分析问题、解决问题的能力,该题涉及氧化还原反应离子方程式的书写以及氧化还原滴定,虽然基于反应原理与中和滴定不同,但实验原理及操作和所用仪器等类似,由于该反应有明显的颜色变化,故可不用指示剂.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
10.下列有机物命名正确的是( )
| A. |  2-乙基丙烷 2-乙基丙烷 | B. | CH3CH2C≡CH 1-丁炔 | ||
| C. |  间二甲苯 间二甲苯 | D. |  2-甲基-2-丙烯 2-甲基-2-丙烯 |
11.某化学兴趣小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
请回答:
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度(或反应物浓度),反应速率增大.
(2)利用实验1数据计算,用KMnO4的浓度变化表示反应速率 (KMnO4)=1.5×10-2mol•L-1•min-1或0.015 mol•L-1•min-1.
(3)该小组同学根据经验绘制了 (Mn2+) 随时间变化趋势的示意图,如图甲所示.但有同学查阅已有的实验资料发现,该实验过程中 (Mn2+) 随时间变化的趋势应如图乙所示. 该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究.
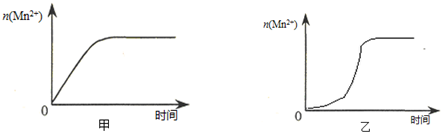
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并选择表中空白处应加入的物质.
A.KMnO4 B.H2C2O4 C.K2SO4 D.MnSO4
③若该小组同学提出的假设成立,应观察到的现象是实验4与实验1比较,溶液褪色所需时间短 或:溶液褪色所用时间(t)小于4min.
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度(或反应物浓度),反应速率增大.
(2)利用实验1数据计算,用KMnO4的浓度变化表示反应速率 (KMnO4)=1.5×10-2mol•L-1•min-1或0.015 mol•L-1•min-1.
(3)该小组同学根据经验绘制了 (Mn2+) 随时间变化趋势的示意图,如图甲所示.但有同学查阅已有的实验资料发现,该实验过程中 (Mn2+) 随时间变化的趋势应如图乙所示. 该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究.

①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并选择表中空白处应加入的物质.
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | ||
③若该小组同学提出的假设成立,应观察到的现象是实验4与实验1比较,溶液褪色所需时间短 或:溶液褪色所用时间(t)小于4min.
16.在较高温度下的某溶液中,硝酸钾、氯化钠均达饱和,冷却析出晶体的成分是( )
| A. | 纯硝酸钾晶体 | B. | 大量硝酸钾晶体,少量氯化钠 | ||
| C. | 等量的硝酸钾和氯化钠 | D. | 大量氯化钠,少量硝酸钾 |
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: 某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:
某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下: