题目内容
5.下列措施中使得氨水的电离平衡向正方向移动的是( )| A. | 加入氯化铵晶体 | B. | 加入氢氧化钠溶液 | ||
| C. | 加入硫酸溶液 | D. | 加入氯化钾晶体 |
分析 氨水中存在电离平衡NH3•H2O?NH4++OH-,若要使平衡向正反应方向移动,可以减小铵根离子或氢氧根离子浓度,如加入稀硫酸或驾驶稀释等,据此进行解答.
解答 解:A.加入氯化铵,溶液中铵根离子浓度增大,氨水的电离平衡向着逆向移动,故A错误;
B.加入氢氧化钠溶液后,溶液中氢氧根离子浓度增大,平衡向着逆向移动,故B错误;
C.加入稀硫酸,氢离子与氢氧根离子反应,导致氨水的电离平衡向着正向移动,故C正确;
D.加入氯化钾晶体,氯离子和钾离子不影响氨水的电离平衡,故D错误;
故选C.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,明确影响弱电解质电离平衡的因素为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
16.已知A、B、C、D的原子序数都不超过18,它们的离子aAm+、bBn+、cCm-、dDn- (m>n)均具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子序数:a>b>c>d | |
| B. | 离子半径:aAm+>bBn+>cCm->dDn- | |
| C. | 离子还原性:aA(n+1)+>bBn+,离子氧化性:cCm->dDn- | |
| D. | 单质还原性:B>A,单质氧化性:D>C |
20.下列各项中,表达正确的是( )
| A. | O原子的结构示意图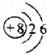 | B. | CH4分子的比例模型 | ||
| C. | C2H2分子的结构式CH≡CH | D. | N2分子的电子式 |
10.下列有机物命名正确的是( )
| A. |  2-乙基丙烷 2-乙基丙烷 | B. | CH3CH2C≡CH 1-丁炔 | ||
| C. |  间二甲苯 间二甲苯 | D. |  2-甲基-2-丙烯 2-甲基-2-丙烯 |
19.有A、B两种烃,含碳的质量分数相同,下列关于A和B的叙述中正确的是( )
| A. | A和B不可能是同系物 | |
| B. | A和B一定是同分异构体 | |
| C. | A和B最简式一定相同 | |
| D. | 等物质的量的A和B完全燃烧生成等质量的CO2 |
 工业上合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g)△H<0.500℃,5MPa条件下,将0.20mol CO与0.58mol H2的混合气体充入2L恒容密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示
工业上合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g)△H<0.500℃,5MPa条件下,将0.20mol CO与0.58mol H2的混合气体充入2L恒容密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示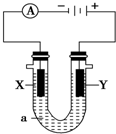 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: 某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:
某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下: