题目内容
4.用R代表短周期元素,R最外层的2p能级上的未成对电子有3个,下列关于R的描述正确的是( )| A. | R的氧化物一定能溶于水 | |
| B. | R的最高价氧化物对应水化物是H2RO3 | |
| C. | R的氢化物的水溶液呈碱性 | |
| D. | R的氧化物都能与NaOH反应 |
分析 R代表短周期元素,R原子最外层的2p亚层上的未成对电子只有3个,则R的价层电子排布可能为2s22p3,R为N元素,结合元素对应的单质、化合物的性质解答.
解答 解:A、一氧化氮不溶于水,故A错误;
B、R的最高价氧化物对应水化物是硝酸,化学式为HRO3,故B错误;
C、氨气是中学阶段中唯一的碱性气体,故C正确;
D、一氧化氮不能与氢氧化钠反应,故D错误;
故选C.
点评 本题考查原子结构与元素周期律的关系,题目难度不大,本题注意把握常见元素的核外电子排布,根据核外电子排布特点正确判断元素的种类,把握常见元素化合物的性质.

练习册系列答案
相关题目
9. 某学生利用物质间的互变,设计成一个平面魔方,如图所示:
某学生利用物质间的互变,设计成一个平面魔方,如图所示:
已知:
①A、B、C、D、G含有同种元素.
②E 是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀.B具有氧化性,液显黄色,能将SO2氧化为F(H2SO4),F与A反应生成E、G.
③
依据以上信息填空:
(1)请写出E的电子式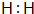 .
.
(2)D的化学式Fe2O3.
(3)请写出ABCDG所含的同种元素的原子结构示意图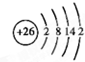 .
.
(4)G生成C的过程中所出现的现象为先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色
(5)写出A→B化学方程式:2Fe+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3
(6)B→F的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
 某学生利用物质间的互变,设计成一个平面魔方,如图所示:
某学生利用物质间的互变,设计成一个平面魔方,如图所示:已知:
①A、B、C、D、G含有同种元素.
②E 是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀.B具有氧化性,液显黄色,能将SO2氧化为F(H2SO4),F与A反应生成E、G.
③
| 纯A(单质) | B溶液 | C固体 | D固体 | G溶液 |
| 颜色 | 银白色(粉末状时为黑色)黄色红 | 褐色 | 红棕色 | 浅绿色 |
(1)请写出E的电子式
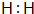 .
.(2)D的化学式Fe2O3.
(3)请写出ABCDG所含的同种元素的原子结构示意图
 .
.(4)G生成C的过程中所出现的现象为先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色
(5)写出A→B化学方程式:2Fe+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3
(6)B→F的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
16.已知A、B、C、D的原子序数都不超过18,它们的离子aAm+、bBn+、cCm-、dDn- (m>n)均具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子序数:a>b>c>d | |
| B. | 离子半径:aAm+>bBn+>cCm->dDn- | |
| C. | 离子还原性:aA(n+1)+>bBn+,离子氧化性:cCm->dDn- | |
| D. | 单质还原性:B>A,单质氧化性:D>C |
 工业上合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g)△H<0.500℃,5MPa条件下,将0.20mol CO与0.58mol H2的混合气体充入2L恒容密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示
工业上合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g)△H<0.500℃,5MPa条件下,将0.20mol CO与0.58mol H2的混合气体充入2L恒容密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示 .
.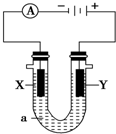 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: 某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:
某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下: