题目内容
18.下列有关实验装置进行的相应实验,不能达到实验目的是( )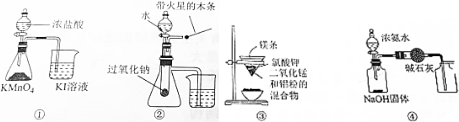
| A. | 用图①装置比较KMnO4、Cl2、I2的氧化性强弱 | |
| B. | 用图②装置验证过氧化钠与水反应既生成氧气又放热 | |
| C. | 用图③装置可制得金属锰 | |
| D. | 用图④装置制取并收集干燥纯净的NH3 |
分析 A.氧化剂的氧化性大于氧化产物;
B.检验是否有氧气生成,用带火星的木条检验即可,检验放热利用气体的热胀冷缩原理;
C.铝的还原性较强,能和二氧化锰发生铝热反应冶炼Mn;
D.氨气密度比空气小.
解答 解:A.2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,Cl2+2KI=I2+2KCl,氧化剂氧化性强弱关系为KMnO4>Cl2 >I2,故A正确;
B.2H2O+2Na2O2=O2↑+4NaOH,把一根带火星的木条放在管口处,木条复燃,证明是氧气,盛放过氧化钠的试管是封闭的,封闭了一段空气,当过氧化钠和水反应放热,气体被加热,体积膨胀,通过支管向烧杯中排放,看到烧杯水中有气泡说明该反应放热,故B正确;
C.铝具有强还原性,高温下,能将部分金属氧化物还原为金属单质,如:能将二氧化锰还原为锰,该反应为铝热反应,故C正确;
D.氨气密度比空气小,应用向下排空气法收集,故D错误.
故选D.
点评 本题考查了化学实验方案评价,明确实验原理是解本题关键,根据物质的性质分析解答,知道常见气体的制备、干燥及收集方法,题目难度不大.

练习册系列答案
相关题目
8.短周期元素Q、W、X、Y、Z在元素周期表中的对应位置如图所示,其中只有Z为金属元素.下列说法正确的是( )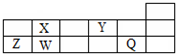

| A. | W、X两元素在自然界中都存在相应的单质 | |
| B. | Q、Y分别与钠元素形成的化合物中仅含离子键 | |
| C. | 简单离子半径由大到小的顺序为:Q>Y>Z | |
| D. | X、Z的最高价氧化物对应的水化物之间易发生化学反应 |
9. 某学生利用物质间的互变,设计成一个平面魔方,如图所示:
某学生利用物质间的互变,设计成一个平面魔方,如图所示:
已知:
①A、B、C、D、G含有同种元素.
②E 是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀.B具有氧化性,液显黄色,能将SO2氧化为F(H2SO4),F与A反应生成E、G.
③
依据以上信息填空:
(1)请写出E的电子式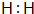 .
.
(2)D的化学式Fe2O3.
(3)请写出ABCDG所含的同种元素的原子结构示意图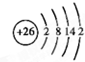 .
.
(4)G生成C的过程中所出现的现象为先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色
(5)写出A→B化学方程式:2Fe+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3
(6)B→F的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
 某学生利用物质间的互变,设计成一个平面魔方,如图所示:
某学生利用物质间的互变,设计成一个平面魔方,如图所示:已知:
①A、B、C、D、G含有同种元素.
②E 是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀.B具有氧化性,液显黄色,能将SO2氧化为F(H2SO4),F与A反应生成E、G.
③
| 纯A(单质) | B溶液 | C固体 | D固体 | G溶液 |
| 颜色 | 银白色(粉末状时为黑色)黄色红 | 褐色 | 红棕色 | 浅绿色 |
(1)请写出E的电子式
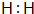 .
.(2)D的化学式Fe2O3.
(3)请写出ABCDG所含的同种元素的原子结构示意图
 .
.(4)G生成C的过程中所出现的现象为先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色
(5)写出A→B化学方程式:2Fe+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3
(6)B→F的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
6.下列物质既能发生加成反应、加聚反应、取代反应,又能发生氧化反应、还原反应的是( )
①
②
③
④CH=C-CH2-CH3
⑤
⑥CH2=CH-C2H5.
①

②

③

④CH=C-CH2-CH3
⑤

⑥CH2=CH-C2H5.
| A. | ②③⑤ | B. | ②④⑥ | C. | ③④⑥ | D. | ①②③④⑥ |
3.草毒、香蕉等水果具有芳香气味,是因为其中含有乙酸乙酯(化学式为C4H8O2)等物质,下列关于乙酸乙酷的说法不正确的是( )
| A. | 该物质属于氧化物 | |
| B. | 乙酸与乙醇反应生成乙酸乙酯属于取代反应 | |
| C. | 该物质的相对分子质量为88 | |
| D. | 乙酸乙酯燃烧有二氧化碳和水生成 |
10.下列有机物命名正确的是( )
| A. |  2-乙基丙烷 2-乙基丙烷 | B. | CH3CH2C≡CH 1-丁炔 | ||
| C. |  间二甲苯 间二甲苯 | D. |  2-甲基-2-丙烯 2-甲基-2-丙烯 |
11.某化学兴趣小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
请回答:
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度(或反应物浓度),反应速率增大.
(2)利用实验1数据计算,用KMnO4的浓度变化表示反应速率 (KMnO4)=1.5×10-2mol•L-1•min-1或0.015 mol•L-1•min-1.
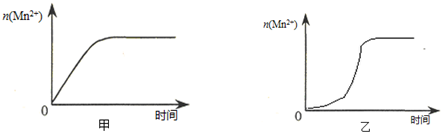
(3)该小组同学根据经验绘制了 (Mn2+) 随时间变化趋势的示意图,如图甲所示.但有同学查阅已有的实验资料发现,该实验过程中 (Mn2+) 随时间变化的趋势应如图乙所示. 该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究.
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并选择表中空白处应加入的物质.
A.KMnO4 B.H2C2O4 C.K2SO4 D.MnSO4
③若该小组同学提出的假设成立,应观察到的现象是实验4与实验1比较,溶液褪色所需时间短 或:溶液褪色所用时间(t)小于4min.
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度(或反应物浓度),反应速率增大.
(2)利用实验1数据计算,用KMnO4的浓度变化表示反应速率 (KMnO4)=1.5×10-2mol•L-1•min-1或0.015 mol•L-1•min-1.
(3)该小组同学根据经验绘制了 (Mn2+) 随时间变化趋势的示意图,如图甲所示.但有同学查阅已有的实验资料发现,该实验过程中 (Mn2+) 随时间变化的趋势应如图乙所示. 该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究.

①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并选择表中空白处应加入的物质.
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | ||
③若该小组同学提出的假设成立,应观察到的现象是实验4与实验1比较,溶液褪色所需时间短 或:溶液褪色所用时间(t)小于4min.
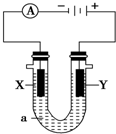 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: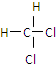 和
和