题目内容
12.下列实验不能达到实验目的是( )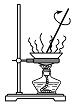 | 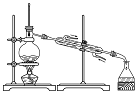 | 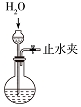 | 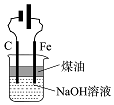 |
| A.蒸发氯化铝溶液的AlCl3 | B.分离乙酸钠和乙醇的混合液 | C.检查装置的气密性 | D.制备Fe(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.加热时氯化铝易水解;
B.乙醇易挥发;
C.关闭止水夹,加入水,观察液面是否变化;
D.铁为阳极,可生成氢氧化亚铁.
解答 解:A.加热时氯化铝易水解,生成盐酸挥发,蒸发得到氢氧化铝,故A错误;
B.乙醇易挥发,可用蒸馏的方法分离,故B正确;
C.关闭止水夹,加入水,观察分液漏斗下端液面是否变化,故C正确;
D.铁为阳极,且溶液呈碱性,可生成氢氧化亚铁,煤油可防止氢氧化亚铁被氧化,故D正确.
故选A.
点评 本题考查较为综合,涉及物质的制备、分离等操作,为高考常见题型,侧重考查学生的分析能力和实验能力,注意把握实验的可行性的评价,难度不大.

练习册系列答案
相关题目
2.在向盛有氯化铁溶液的烧杯中加入过量铜粉,反应结束后过滤,对溶液中大量存在的金属阳离子的成分判断正确的是( )
| A. | 只有Cu2+ | B. | Fe2+、Cu2+ | C. | Fe3+、Fe2+ | D. | Fe3+、Cu2+ |
20.下列实验能达到预期目的是( )
| 编号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸测得:0.1mol•L-1Na2SO3溶液的pH约为10;0.1mol•L-1NaHSO3溶液的pH约为5 | HSO3-结合H+的能力比SO32-强 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 配置FeCl2溶液时,先将FeCl2固体溶于适量盐酸中,再用蒸馏水稀释到所需浓度,最后向试剂瓶中加入少量铜粉 | 抑制Fe2+2水解,并防止Fe2+被氧化 |
| D | 向10mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,在滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| A. | A | B. | B | C. | C | D. | D |
17.下列关于有机化合物的说法正确的是( )
| A. | 2-甲基丁烷也称异丁烷 | |
| B. | 乙烯、苯都能发生加成反应 | |
| C. | 乙烯、聚氯乙烯分子中都含有碳碳双键 | |
| D. | 淀粉、油脂、蛋白质都属于高分子化合物 |
4.下列装置用于实验室制备氨气并配制银氨溶液,不能达到实验目的是( )
| A. |  检查气密性 检查气密性 | B. |  制备氨气 | C. |  吸收氨尾气 | D. |  配制银氨溶液 |
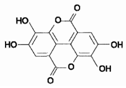 紫薯中的鞣花酸(结构如图)具有防癌和抗癌作用.
紫薯中的鞣花酸(结构如图)具有防癌和抗癌作用.
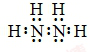 ;N2H4在水中的第一步电离方程式为N2H4+H2O?N2H5++OH-
;N2H4在水中的第一步电离方程式为N2H4+H2O?N2H5++OH- 铜与浓硝酸反应和铜与稀硝酸反应的产物不同,实验现象也不同.
铜与浓硝酸反应和铜与稀硝酸反应的产物不同,实验现象也不同.