题目内容
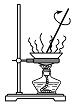
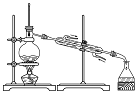
4.下列装置用于实验室制备氨气并配制银氨溶液,不能达到实验目的是( )| A. |  检查气密性 检查气密性 | B. |  制备氨气 | C. |  吸收氨尾气 | D. |  配制银氨溶液 |
分析 A.装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;
B.氯化铵受热无法制取氨气,实验室用加热铵盐和碱的固体混合物制取氨气;
C.吸收易溶性气体时,容易出现倒吸现象,可以通过特殊的装置来防止倒吸;
D.配制银氨溶液,应将氨水滴加到硝酸银溶液中,当生成的沉淀完全溶解时,可停止滴加氨水.
解答 解:A.对于该装置的气密性检查,主要是通过气体受热后体积膨胀、压强增大来进行检验.即用手握住试管外壁,如果装置漏气,压强不变化,就无现象;如果装置不漏气,温度升高,压强就变大就会在导管口产生气泡,所以能检查出装置是否漏气,故A正确;
B.氯化铵受热生成氯化氢和氨气两种气体,且在试管口反应生成氯化铵,无法制取氨气,实验室用加热氯化氨和消石灰的固体混合物制取氨气,方程式为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O,故B错误;
C.氨气为易溶于水的气体,需用防倒吸装置,球形干燥管,在球形部分有相对较大的空间,这样可以防止倒吸现象的发生,故C正确;
D.往AgNO3溶液中逐滴加入氨水,银离子和氨水反应生成白色的氢氧化银沉淀和铵根离子,离子反应方程式为:Ag++NH3•H2O═AgOH↓+NH4+;继续滴入氨水白色沉淀溶解,氢氧化银和氨水反应生成银氨溶液和水,离子反应方程式为:AgOH+2NH3•H2O═[Ag(NH3)2]OH+2H2O,边滴边振荡直滴到沉淀恰好溶解为止,故D正确;
故选B.
点评 本题考查氨气制备、银氨溶液配制等知识,综合考查学生的分析能力、实验能力和评价能力,为高考常见题型,注意把握物质的性质以及实验的严密性和可行性的评价,题目难度不大.

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案| A. | NO3-,K+,[Al(OH)4]-,OH- | B. | Na+,Ba2+,Mg2+,HCO3- | ||
| C. | NO3-,Mg2+,K+,Cl- | D. | NH4+,NO3-,CO32-,Na+ |
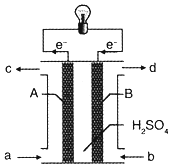 “长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分).某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,下列说法正确的是( )
“长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分).某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,下列说法正确的是( )| A. | A为正极 | |
| B. | 电池工作时H+由A极向B极迁移 | |
| C. | 从b 口通入四氧化二氮气体且在B极发生氧化反应 | |
| D. | A极发生的电极反应式:C2H8N2+4H2O+16e-═2CO2+N2+16H+ |
| A. | 工业电解精炼铜时,粗铜与外电源的正极相连 | |
| B. | 常温下向纯水中加入盐酸,水的离子积减小 | |
| C. | 催化剂既能改变化学反应速率,也能改变焓变 | |
| D. | 其它条件不变时,升髙温度,吸热反应的v(正)增大,v(逆)减小 |
 脑白金又名褪黑激素,据报道它几有提高免疫力.促进睡眠等功能.其结构简式为:下列有关脑白金说法不正确的是( )
脑白金又名褪黑激素,据报道它几有提高免疫力.促进睡眠等功能.其结构简式为:下列有关脑白金说法不正确的是( )| A. | 能发生加成反应 | B. | 属于芳香族化合物 | ||
| C. | 分子式为C13H16N2O2 | D. | 不能使酸性高锰酸钾溶液褪色 |
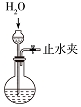
| A. | 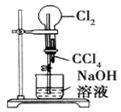 打开止水夹,挤压装置如图的胶头滴管使CCl4全部进入烧瓶 | |
| B. | 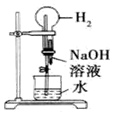 打开止水夹,挤压如图装置的胶头滴管使NaOH溶液全部进入烧瓶 | |
| C. | 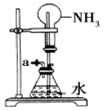 打开止水夹,用鼓气装置从如图装置的a处不断鼓入空气 | |
| D. |  打开止水夹,向如图装置的水槽中慢慢加入足量浓硫酸 |
| A. | 分散质微粒直径的大小关系:溶液>胶体>浊液 | |
| B. | 利用丁达尔效应可以区别溶液与胶体 | |
| C. | 胶体粒子比较小,可以通过半透膜 | |
| D. | 电泳现象可证明胶体属于电解质溶液 |