题目内容
8.(1)在MgCl2溶液中滴加过量NaOH溶液,反应现象是产生白色沉淀,有关的离子方程式为Mg2++2OH-=Mg(OH)2↓;(2)向盛有10mL 0.1mol/LAlCl3溶液的试管中滴入0.1mol/LNaOH溶液,边滴加边震荡,当加入15或者45毫升NaOH时,产生的沉淀为最大量时的一半.
分析 (1)氯化镁溶液与氢氧化钠溶液反应生成氢氧化镁沉淀和氯化钠;
(2)氯化铝与氢氧化钠反应,先生成沉淀,然后沉淀溶解,所以产生的沉淀为最大量时的一半,有两种情况,一种氢氧化钠不足,只沉淀一半铝离子,另一种情况铝离子全部被沉淀,剩余的氢氧化钠又溶解一半氢氧化铝沉淀,据此解答.
解答 解:(1)氯化镁溶液与氢氧化钠溶液反应生成氢氧化镁沉淀和氯化钠,离子方程式:Mg2++2OH-=Mg(OH)2↓,氢氧化镁为白色沉淀;
故答案为:产生白色沉淀;Mg2++2OH-=Mg(OH)2↓;
(2)氯化铝与氢氧化钠反应,先生成沉淀,然后沉淀溶解,所以产生的沉淀为最大量时的一半,有两种情况,一种氢氧化钠不足,只沉淀一半铝离子,发生反应方程式:AlCl3+3NaOH=Al(OH)3↓+3NaCl,消耗氢氧化钠物质的量为:$\frac{1}{2}$×0.1mol/L×0.01L×3=0.0015mol,体积为:$\frac{0.0015mol}{0.1mol/L}$=0.0015L,即15mL;
另一种情况,开始发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl,AlCl3完全反应需要NaOH的物质的量=3n(AlCl3)=0.001mol×3=0.003mol,然后一半氢氧化铝沉淀溶解发生反应Al(OH)3+NaOH=NaAlO2+H2O,依据方程式消耗氢氧化钠物质的量为0.0015mol,共消耗氢氧化钠0.0045mol,体积为:$\frac{0.0045mol}{0.1mol/L}$=45mL;
故答案为:15或者45.
点评 本题考查了离子方程式的书写及有关计算,明确铝及其化合物之间转化是解题关键,题目难度中等.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
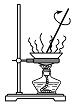
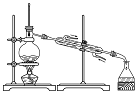
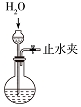
19.以下是某兴趣小组设计的4个喷泉实验方案,下列有关操作无法引发喷泉现象的是( )
| A. | 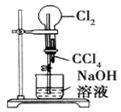 打开止水夹,挤压装置如图的胶头滴管使CCl4全部进入烧瓶 | |
| B. | 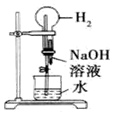 打开止水夹,挤压如图装置的胶头滴管使NaOH溶液全部进入烧瓶 | |
| C. | 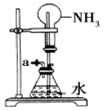 打开止水夹,用鼓气装置从如图装置的a处不断鼓入空气 | |
| D. |  打开止水夹,向如图装置的水槽中慢慢加入足量浓硫酸 |
16.高铁酸钾(K2FeO4,4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-)是一种新型的自来水处理剂,它的性质和作用是( )
| A. | 有强氧化性,可消毒杀菌,还原产物能吸附水中杂质 | |
| B. | 有强还原性,可消毒杀菌,氧化产物能吸附水中杂质 | |
| C. | 有强氧化性,能吸附水中杂质,还原产物能消毒杀菌 | |
| D. | 有强还原性,能吸附水中杂质,氧化产物能消毒杀菌 |
20.下列叙述正确的是( )
| A. | 分散质微粒直径的大小关系:溶液>胶体>浊液 | |
| B. | 利用丁达尔效应可以区别溶液与胶体 | |
| C. | 胶体粒子比较小,可以通过半透膜 | |
| D. | 电泳现象可证明胶体属于电解质溶液 |
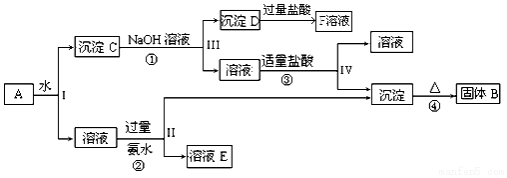
17.卤块主要成分是MgCl2,还含此外还含Fe2+、Fe3+和Mn2+等杂质离子.以卤块为原料按如图所示流程进行生产,可制得轻质氧化镁.
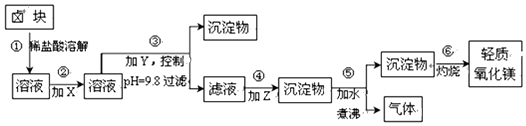
相关数据:
请根据表提供的资料回答:
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的a、c、d(选填试剂编号).
(2)步骤②发生反应的离子方程式为2Fe2++ClO-+2H+=Cl-+2Fe3++H2O;步骤⑤中发生反应的化学方程为MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+CO2↑.
(3)为尽量除去杂质,步骤③控制pH为9.8时,停止加入Y.调节为该pH的目的是使Mg2+以外的杂质尽可能彻底地转化为沉淀除去.
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是ABCE.
A.酒精喷灯 B.铁三角架 C.坩埚 D.蒸发皿 E.泥三角 F.烧杯 G.石棉网
(5)已知在25℃时,Ksp[Mg(OH)2)=3.2×10-11,向0.02mol•L-1的MgCL2溶液中加入NaOH固体,如要生成Mg( OH )2沉淀,应使溶液中的c( OH-)最小为4×10-5 mol•L-1.
(6)为了分析制取的产品中残留铁元素的含量,取5g产品,先将Fe3+预处理为Fe2+后配制成100mL溶液,取25.00mL,用0.01mol•L-1KMnO4标准溶液在酸性条件下进行滴定.
①滴定前是否要滴加指示剂?否(填“是”或“否”),请说明理由KMnO4溶液的紫红色可指示反应终点.
②终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是4.480%.
(7)判断下列操作对测定结果的影响(填“偏高“、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的KMnO4溶液有少量溅出,使测定结果偏高.
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果偏低.

相关数据:
| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6 | b.双氧水(含30%H2O2) | 1500 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2200 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO) | 800 |
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的a、c、d(选填试剂编号).
(2)步骤②发生反应的离子方程式为2Fe2++ClO-+2H+=Cl-+2Fe3++H2O;步骤⑤中发生反应的化学方程为MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+CO2↑.
(3)为尽量除去杂质,步骤③控制pH为9.8时,停止加入Y.调节为该pH的目的是使Mg2+以外的杂质尽可能彻底地转化为沉淀除去.
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是ABCE.
A.酒精喷灯 B.铁三角架 C.坩埚 D.蒸发皿 E.泥三角 F.烧杯 G.石棉网
(5)已知在25℃时,Ksp[Mg(OH)2)=3.2×10-11,向0.02mol•L-1的MgCL2溶液中加入NaOH固体,如要生成Mg( OH )2沉淀,应使溶液中的c( OH-)最小为4×10-5 mol•L-1.
(6)为了分析制取的产品中残留铁元素的含量,取5g产品,先将Fe3+预处理为Fe2+后配制成100mL溶液,取25.00mL,用0.01mol•L-1KMnO4标准溶液在酸性条件下进行滴定.
①滴定前是否要滴加指示剂?否(填“是”或“否”),请说明理由KMnO4溶液的紫红色可指示反应终点.
②终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是4.480%.
(7)判断下列操作对测定结果的影响(填“偏高“、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的KMnO4溶液有少量溅出,使测定结果偏高.
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果偏低.
2.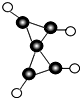 科学家最近在-100℃的低温下合成了一种化合物X,此分子的模型如图所示,其中黑圆代表碳原子,白圆代表氢原子,下列说法中不正确的是( )
科学家最近在-100℃的低温下合成了一种化合物X,此分子的模型如图所示,其中黑圆代表碳原子,白圆代表氢原子,下列说法中不正确的是( )
 科学家最近在-100℃的低温下合成了一种化合物X,此分子的模型如图所示,其中黑圆代表碳原子,白圆代表氢原子,下列说法中不正确的是( )
科学家最近在-100℃的低温下合成了一种化合物X,此分子的模型如图所示,其中黑圆代表碳原子,白圆代表氢原子,下列说法中不正确的是( )| A. | 该分子的分子式C5H4 | |
| B. | 1mol该物质完全燃烧生成CO2与H2O时需耗6 mol O2 | |
| C. | 该物质完全燃烧生成的CO2与H2O的分子数比为5:4 | |
| D. | 1mol该物质完全燃烧生成CO2与H2O时转移电子数为24 NA |