题目内容
2.在向盛有氯化铁溶液的烧杯中加入过量铜粉,反应结束后过滤,对溶液中大量存在的金属阳离子的成分判断正确的是( )| A. | 只有Cu2+ | B. | Fe2+、Cu2+ | C. | Fe3+、Fe2+ | D. | Fe3+、Cu2+ |
分析 铁离子具有强氧化性,铁离子能够与过量的铜反应生成氯化铜与氯化亚铁,所以反应后溶液中存在亚铁离子、铜离子,据此进行解答.
解答 解:向盛有氯化铁溶液的烧杯中加入过量铜粉,会发生化学反应:Cu+2FeCl3═CuCl2+2FeCl2,反应结束后,溶液中大量存在的金属离子是Cu2+、Fe2+,
故选B.
点评 本题考查了铁离子的化学性质,题目难度不大,注意明确铁离子具有氧化性,能够与金属铜发生氧化还原反应生成铜离子和亚铁离子,注意Cu过量.

练习册系列答案
相关题目
9.人们对原子结构的认识有一个不断深入的过程,其中提出“葡萄干面包”原子模型的科学家是( )
| A. | 道尔顿 | B. | 汤姆生 | C. | 卢瑟福 | D. | 玻尔 |
10.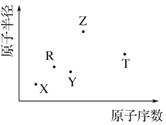 短周期主族元素 X、Y、Z、R、T 的原子半径与原子序数关系如图 所示.R 原子最外层电子数是电子层数的 2 倍,Y 与 Z 能形成 Z2Y、Z2Y2型离子化合物,Z 与 T 形成的化合物 Z2T 能破坏水的电离平衡.下列推断正确的是( )
短周期主族元素 X、Y、Z、R、T 的原子半径与原子序数关系如图 所示.R 原子最外层电子数是电子层数的 2 倍,Y 与 Z 能形成 Z2Y、Z2Y2型离子化合物,Z 与 T 形成的化合物 Z2T 能破坏水的电离平衡.下列推断正确的是( )
 短周期主族元素 X、Y、Z、R、T 的原子半径与原子序数关系如图 所示.R 原子最外层电子数是电子层数的 2 倍,Y 与 Z 能形成 Z2Y、Z2Y2型离子化合物,Z 与 T 形成的化合物 Z2T 能破坏水的电离平衡.下列推断正确的是( )
短周期主族元素 X、Y、Z、R、T 的原子半径与原子序数关系如图 所示.R 原子最外层电子数是电子层数的 2 倍,Y 与 Z 能形成 Z2Y、Z2Y2型离子化合物,Z 与 T 形成的化合物 Z2T 能破坏水的电离平衡.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 最高价氧化物对应水化物的酸性:T<R | |
| C. | 氢化物的沸点不一定是:Y>R | |
| D. | 由 X、R、Y、Z 四种元素组成的化合物水溶液一定显碱性 |
17.对于有机物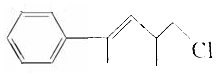 的下列叙述中不正确的是( )
的下列叙述中不正确的是( )
 的下列叙述中不正确的是( )
的下列叙述中不正确的是( )| A. | 分子式是C12H15Cl,属于卤代烃 | |
| B. | 1mol该物质最多能与4molH2发生加成反应 | |
| C. | 既能使溴水褪色,又能使KMnO4 酸性溶液褪色 | |
| D. | 该溶液与酸化的AgNO3 溶液混合时会产生白色沉淀 |
7.运动会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生的化学反应为5KClO3+6P=3P2O5+5KCl.下列有关该反应的叙述不正确的是( )
| A. | KClO3是氧化剂 | B. | P2O5是氧化产物 | ||
| C. | 1molKClO3参加反应有6mole-转移 | D. | 每有6molP被还原,生成5molKCl |
14.在加入铝粉能产生H2的溶液中,下列各组离子可能大量共存的是( )
| A. | NO3-,K+,[Al(OH)4]-,OH- | B. | Na+,Ba2+,Mg2+,HCO3- | ||
| C. | NO3-,Mg2+,K+,Cl- | D. | NH4+,NO3-,CO32-,Na+ |
11.下列有关乙醇的说法正确的是( )
| A. | 能与H2O发生加成反应 | B. | 能使石蕊试液变红 | ||
| C. | 与CH3OCH3互为同分异构体 | D. | 是食醋的主要成分 |
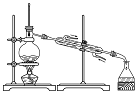
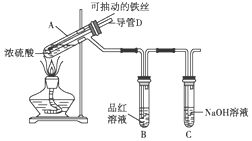 合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.
合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.