题目内容
19.在盛有稀硫酸的烧杯中,放入用导线连接的铜片和锌片,下列说法正确的是( )| A. | 一段时间负极质量明显减轻 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 只有正极上有氢气逸出,正极电极反应式为:2H++2e-═H2↑ | |
| D. | 正极附近的SO42-离子浓度逐渐增大 |
分析 铜-锌-稀硫酸原电池中,活泼金属锌作负极,铜作正极;负极上锌失电子生成锌离子,正极上氢离子得电子生成氢气;溶液中阴离子向负极移动,阳离子向正极移动;由此分析解答.
解答 解:A、负极锌失电子,变成锌离子,所以一段时间负极质量明显减轻,故A正确;
B、铜-锌-稀硫酸原电池中,活泼金属锌作负极,铜作正极,原电池放电时,电子从负极锌沿导线流向正极铜,故B错误;
C、正极上氢离子得电子生成氢气,正极电极反应式为:2H++2e-═H2↑,故C正确;
D、该原电池放电时,溶液中阴离子向负极移动,阳离子向正极移动,所以硫酸根离子向负极移动,负极附近SO42-浓度逐渐增大,故D错误;
故选:AC.
点评 本题考查了原电池原理,难度不大,易错点为:判断溶液中阴阳离子的移动方向.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9. 若甲、丙为短周期、同一主族元素形成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为①钠和氢气 ②氟气和氧气 ③碳和硅 ④氯气和液溴( )
若甲、丙为短周期、同一主族元素形成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为①钠和氢气 ②氟气和氧气 ③碳和硅 ④氯气和液溴( )
 若甲、丙为短周期、同一主族元素形成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为①钠和氢气 ②氟气和氧气 ③碳和硅 ④氯气和液溴( )
若甲、丙为短周期、同一主族元素形成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为①钠和氢气 ②氟气和氧气 ③碳和硅 ④氯气和液溴( )| A. | ①③ | B. | ①④ | C. | ③ | D. | ②④ |
10.下列说法正确的是( )
| A. | MgF2晶体中的化学键是共价键 | |
| B. | 在共价化合物中一定存在共价键 | |
| C. | N2和CH4两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 离子化合物一定只含离子键 |
7.下列选项中能发生化学反应,且甲组为取代反应、乙组为加成反应的是( )
| 甲 | 乙 | |
| A | 苯与溴水 | 乙烯与水制乙醇(催化剂) |
| B | 油脂水解 | 苯与氢气(催化剂、加热) |
| C | 甲烷与氯气(在光亮处) | 乙酸和乙醇的酯化反应(催化剂、加热) |
| D | 乙烯与溴的四氯化碳溶液 | 乙醇与钠反应 |
| A. | A | B. | B | C. | C | D. | D |
4.下列说法正确的是( )
| A. | 原子半径大小:Ca>S | B. | 金属性强弱:Na<Mg | ||
| C. | 酸性强弱:HBrO4>HClO4 | D. | 碱性强弱:NaOH>KOH |
11.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ | |
| C. | 上述现象说明[Cu(NH3)4]2+不如Cu(OH)2稳定 | |
| D. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤电子对,NH3提供空轨道 |
8.下列物质的电子式书写正确的是( )
| A. | H:F | B. | 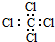 | C. | 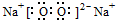 | D. | 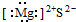 |