题目内容
 已知某种气态矿物燃料含有碳和氢两种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入图所示的装置(气体流向如图),得到如下表所列的实验结果(假设产生的气体完全被吸收).
已知某种气态矿物燃料含有碳和氢两种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入图所示的装置(气体流向如图),得到如下表所列的实验结果(假设产生的气体完全被吸收).| 装置的质量 | 实验前 | 实验后 |
| (固体+U形管A) | 101.1g | 102.9g |
| (固体+U形管B) | 312.0g | 314.2g |
(1)U形管A、B中分别盛放的固体为
(2)通过计算,确定该有机物中C、H元素的质量比_
(3)能否通过C、H元素的质量比确定该有机物的分子式(若“能确定”写出分子式、若“不能确定”说明理由)
考点:化学方程式的有关计算
专题:计算题
分析:(1)因为该燃料含C、H两种元素,故燃烧产物为CO2和H2O,由题意可知U形管A增加的质量为吸收水的质量,U形管B增加的质量为生成的CO2质量,故A中可以盛放氯化钙,B中可以盛放碱石灰;
(2)根据水的分子式中H元素质量分数计算H元素质量、根据二氧化碳中碳元素质量分数计算C元素质量;
(3)根据n=
计算C、H原子数目之比,若符合烷烃组成通式,为可以确定分子式,否则不能确定分子式.
(2)根据水的分子式中H元素质量分数计算H元素质量、根据二氧化碳中碳元素质量分数计算C元素质量;
(3)根据n=
| m |
| M |
解答:
解:(1)因为该燃料含C、H两种元素,故燃烧产物为CO2和H2O,由题意可知U形管A增加的质量为吸收水的质量,U形管B增加的质量为生成的CO2质量,故A中可以盛放氯化钙,B中可以盛放碱石灰,
故答案为:氯化钙;碱石灰;
(2)U形管A增加的质量为吸收水的质量:102.9g-101.1g=1.8g,由H元素守恒可知,该有机物中H元素质量为1.8×
=0.2g,
U形管B增加的质量为生成的CO2质量:314.2g-312.0g=2.2g,由碳元素守恒,有机物中C元素质量=2.2g×
=0.6g,
故该燃料中m(C):m(H)=0.6g:0.3g=3:1,
故答案为:3:1;
(3)有机物中碳原子与氢原子的个数比为
:
=1:4,H原子饱和C的四价结构,所以化学式为CH4,
故答案为:CH4.
故答案为:氯化钙;碱石灰;
(2)U形管A增加的质量为吸收水的质量:102.9g-101.1g=1.8g,由H元素守恒可知,该有机物中H元素质量为1.8×
| 2 |
| 18 |
U形管B增加的质量为生成的CO2质量:314.2g-312.0g=2.2g,由碳元素守恒,有机物中C元素质量=2.2g×
| 12 |
| 44 |
故该燃料中m(C):m(H)=0.6g:0.3g=3:1,
故答案为:3:1;
(3)有机物中碳原子与氢原子的个数比为
| 3 |
| 12 |
| 1 |
| 1 |
故答案为:CH4.
点评:本题考查有机物的燃烧法和元素守恒法是确定有机物分子式,难度中等,(3)中烃的最简式中H原子若饱和C的四价结构,则最简式即为分子式,注意对基础知识的理解掌握.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
 阿司匹林是常见的解热镇痛药,结构简式如图所示,有关阿司匹林的说法正确的是( )
阿司匹林是常见的解热镇痛药,结构简式如图所示,有关阿司匹林的说法正确的是( )| A、能发生取代、酯化反应,但不能发生氧化、还原反应 |
| B、阿司匹林分子中最多可以有13个原子在同一平面上 |
| C、1mol该物质完全氧化最多可消耗10mol氧气 |
| D、1mol该物质最多可与3mol NaOH发生反应 |
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A是组成有机物的必要元素,元素B的原子最外层电子数是其电子层数的3倍,元素D与B为同族元素,元素C与E形成的化合物CE是厨房常用调味品.下列说法正确的是( )
| A、原子半径:D>C>B>A |
| B、C与B只能形成一种化合物 |
| C、A、D、E的最高价氧化物对应水化物的酸性逐渐增强 |
| D、C和E的单质可通过电解饱和的CE水溶液获得 |
下列离子组一定能大量共存的是( )
| A、甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ |
| B、滴加无色酚酞后仍为无色的溶液:Na+、CO32-、K+、ClO-、SO42- |
| C、由水电离的c(OH-)=10-14mol?L-1 的溶液:NO3-、SO42-、Na+、K+ |
| D、含大量Al3+的溶液中:K+、HS-、NO3-、ClO- |
下列有关溶液的描述,正确的是( )
| A、饱和溶液一定是浓溶液 |
| B、冷却热饱和溶液一定有晶体析出 |
| C、溶液一定是均一、稳定的混合物 |
| D、同种溶质的饱和溶液一定比不饱和溶液浓度大 |
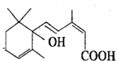 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,回答:
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,回答: