题目内容
18.已知常温下,KSP(AgCl)=1.8×10-10 mol2•L-2,KSP(AgI)=8.3×10-17mol2•L-2,下列叙述中,正确的是( )| A. | 常温下,AgCl 在饱和 NaCl 溶液中的 KSP 比在纯水中的 KSP 小 | |
| B. | 向 AgCl 的悬浊液中加入 KI 溶液,沉淀由白色转化为黄色 | |
| C. | 将 0.001 mol•L-1 的 AgNO3 溶液滴入 KCl 和 KI 的混合溶液中,一定先产生 AgI 沉淀 | |
| D. | 向 AgCl 的饱和溶液中加入 NaCl 晶体,有 AgCl 析出且溶液中 c(Ag+)=c(Cl-) |
分析 A.KSP只与温度有关,温度不变,则难溶物的溶度积不变;
B.溶度积越小,易溶于生成沉淀;
C.Qc与KSP差别越大,越容易生成沉淀;
D.向AgCl的饱和溶液中加入NaCl晶体,溶解平衡逆向移动,生成沉淀,c(Ag+)减小,c(Cl-)增大.
解答 解:A.KSP只与温度有关,与溶液中离子浓度无关,温度不变,则溶度积不变,故A错误;
B.KSP(AgCl)>KSP(AgI),沉淀转化为溶解度更小的物质容易发生,向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色,故B正确;
C.KCl和KI的混合溶液中,c(Cl-)和c(I-)的大小无法比较,所以Qc也无法知道,无法判断Qc与KSP差别大小,也就无法确定沉淀的先后顺序,故C错误;
D.向AgCl的饱和溶液中加入NaCl晶体,溶解平衡逆向移动,生成沉淀,c(Ag+)减小,c(Cl-)增大,c(Ag+)<c(Cl-),故D错误;
故选B.
点评 本题考查难溶电解质的溶解平衡及沉淀转化的本质,为高频考点,题目难度中等,注意难溶物类型相同时,溶度积越小越容易生成沉淀,注意掌握难溶物溶解平衡及其影响因素,试题侧重考查学生的灵活应用能力

练习册系列答案
相关题目
3.下列关于氯气的叙述,不正确的是( )
| A. | 氯气是一种黄绿色的有毒气体 | |
| B. | 灼热的铜丝在氯气中燃烧,生成棕黄色的烟 | |
| C. | 可以用排饱和食盐水法收集氯气 | |
| D. | 氯水、液氯是同一种物质 |
4.已知Cu2O能与硝酸反应,方程式为:3Cu2O+14HNO3═6Cu(NO3)2+2NO↑+7H2O,若生成NO的体积为 0.448L(标况下),那下列说法正确的是( )
| A. | 被氧化的Cu2O为1.44 g | |
| B. | 做氧化剂的硝酸为0.14 mol | |
| C. | 至少需0.5 moI/L硝酸140 mL与Cu2O反应 | |
| D. | 转移的电子总数为0.06 NA |
6.在一定温度下,硫酸铜晶体的培养皿中存在下列平衡:Cu2+(aq)+SO42-(aq)+xH2O(l)?CuSO4•xH2O(s),当向溶液中加少量无水硫酸铜粉末后,下列说法中正确的是( )
| A. | 溶液中Cu2+浓度增大 | B. | 溶液中Cu2+数目减少 | ||
| C. | 该溶液的pH减小 | D. | 溶液的蓝色变浅 |
13. 在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
 在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )| A. | 在t℃时,AgBr的Ksp为4.9×10-13 | |
| B. | 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 | |
| C. | 图中a点对应的是AgBr的不饱和溶液 | |
| D. | 向组成为c点的溶液中加入等体积的0.1 mol/L的氯化钠溶液,可产生AgCl沉淀 |
3.氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间隙法”制取,反应原理、实验装置图(加热装置都已略去)如下:
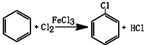
已知:氯苯为无色液体,沸点132.2℃.
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压,冷凝管中冷水应从a(填“a”或“b”) 处通入.
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯.
①对C加热的方法是c(填序号)
a.酒精灯加热 b.油浴加热 c.水浴加热
②D出口的气体成分有HCl、苯蒸汽和氯气;
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本.写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;HCl+NaOH=NaCl+H2O;(写两个即可)
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是五氧化二磷或氯化钙;
(5)工业生产中苯的流失情况如下:
则lt苯可制得成品为$\frac{(1-0.0892)×112.5}{78}$t(只要求列式).

已知:氯苯为无色液体,沸点132.2℃.
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压,冷凝管中冷水应从a(填“a”或“b”) 处通入.
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯.
①对C加热的方法是c(填序号)
a.酒精灯加热 b.油浴加热 c.水浴加热
②D出口的气体成分有HCl、苯蒸汽和氯气;
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本.写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;HCl+NaOH=NaCl+H2O;(写两个即可)
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是五氧化二磷或氯化钙;
(5)工业生产中苯的流失情况如下:
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
8.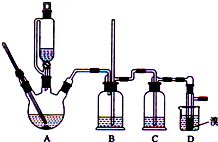 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是D;(填正确选项前的字母)
A.引发反应 B.加快反应速度 C.防止乙醇挥发 D.减少副产物乙醚生成
(2)在装置C中应加入C,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
A.水 B.浓硫酸 C.氢氧化钠溶液 D.饱和碳酸氢钠溶液
(3)判断该制备实验中各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗(填仪器名)中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用B洗涤除去;(填正确选项前的字母)
A.水 B.氢氧化钠溶液 C.碘化钠溶液 D.乙醇
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是冷却,避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是D;(填正确选项前的字母)
A.引发反应 B.加快反应速度 C.防止乙醇挥发 D.减少副产物乙醚生成
(2)在装置C中应加入C,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
A.水 B.浓硫酸 C.氢氧化钠溶液 D.饱和碳酸氢钠溶液
(3)判断该制备实验中各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗(填仪器名)中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用B洗涤除去;(填正确选项前的字母)
A.水 B.氢氧化钠溶液 C.碘化钠溶液 D.乙醇
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是冷却,避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
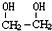 )是一种重要的化工原料,
)是一种重要的化工原料, (g)△H=a kJ/mol
(g)△H=a kJ/mol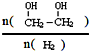 增大的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来(写两条)
增大的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来(写两条)