题目内容
8.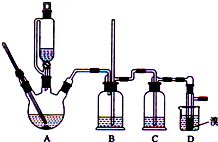 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是D;(填正确选项前的字母)
A.引发反应 B.加快反应速度 C.防止乙醇挥发 D.减少副产物乙醚生成
(2)在装置C中应加入C,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
A.水 B.浓硫酸 C.氢氧化钠溶液 D.饱和碳酸氢钠溶液
(3)判断该制备实验中各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗(填仪器名)中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用B洗涤除去;(填正确选项前的字母)
A.水 B.氢氧化钠溶液 C.碘化钠溶液 D.乙醇
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是冷却,避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
分析 实验室制备1,2-二溴乙烷:三颈烧瓶A中乙醇在浓硫酸的作用下发生分子内脱水生成乙烯,乙醇发生了消去反应,反应方程式为:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
如果D中导气管发生堵塞,A中产生的乙烯气体会导致装置B中压强增大,长导管液面会上升,所以装置B中长玻璃管可检验D装置是否堵塞,装置B起缓冲作用,浓硫酸具有脱水性、吸水性和强氧化性,能氧化乙醇,方式的反应为CH3CH2OH+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4SO2↑+CO2↑+7H2O+C,可能生成的酸性气体为二氧化硫、二氧化碳,装置C中放氢氧化钠溶液,发生反应SO2+2NaOH=Na2SO3+H2O,CO2+2NaOH═Na2CO3+H2O,除去杂质气体,乙烯含有不饱和键C=C双键,能与卤素单质发生加成反应,D中乙烯和溴发生加成生成1,2-二溴乙烷,反应为:CH2=CH2+Br-Br→CH2Br-CH2Br,制得1,2-二溴乙烷;
(1)乙醇在浓硫酸140℃的条件下,发生分子内脱水生成乙醚;
(2)C装置是吸收酸性气体,应该盛放碱性溶液;
(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色;
(4)1,2-二溴乙烷和水不互溶,且1,2-二溴乙烷密度比水大;
(5)常温下下Br2和氢氧化钠发生反应,可以除去混有的溴;
(6)互溶的液体采用蒸馏方法分离;
(7)溴易挥发,温度高时挥发更严重;1,2-二溴乙烷的凝固点较低(9℃).
解答 解:(1)乙醇在浓硫酸140℃的条件下,发生分子内脱水生成乙醚,可能迅速地把反应温度提高到170℃左右,其最主要目的是:减少副产物乙醚生成;
故答案为:D;
(2)C装置是吸收酸性气体,应该盛放碱性溶液,生成的酸性气体有二氧化碳、二氧化硫,NaOH和碳酸氢钠溶液为碱性溶液,但碳酸氢钠饱和溶液和二氧化碳不反应,所以应该选取NaOH溶液,
故答案为:C;
(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,D中溴颜色完全褪去说明反应已经结束,故答案为:溴的颜色完全褪去;
(4)1,2-二溴乙烷和水不互溶,应该采用分液方法分离,所有的仪器是分液漏斗,1,2-二溴乙烷密度比水大,有机层在下层,故答案为:分液漏斗;下;
(5)A.溴更易溶于1,2-二溴乙烷,用水无法除去溴,故A错误;
B.常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,再分液除去,故B正确;
C.NaI与溴反应生成碘,碘与1,2-二溴乙烷互溶,不能分离,故C错误;
D.酒精与1,2-二溴乙烷互溶,不能除去混有的溴,故D错误,
故答案为:B;
(6)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离,故答案为:蒸馏;
(7)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,过度冷却会使其凝固而使气路堵塞,
故答案为:冷却,避免溴的大量挥发;1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
点评 本题考查物质制备,为高频考点,涉及制备原理、物质的分离提纯、实验条件控制、对操作分析评价等,是对基础知识的综合考查,明确化学实验原理、物质性质差异性及实验操作规范性是解本题关键,注意题干信息的正确获取和灵活运用,题目难度不大.

| A. | 常温下,AgCl 在饱和 NaCl 溶液中的 KSP 比在纯水中的 KSP 小 | |
| B. | 向 AgCl 的悬浊液中加入 KI 溶液,沉淀由白色转化为黄色 | |
| C. | 将 0.001 mol•L-1 的 AgNO3 溶液滴入 KCl 和 KI 的混合溶液中,一定先产生 AgI 沉淀 | |
| D. | 向 AgCl 的饱和溶液中加入 NaCl 晶体,有 AgCl 析出且溶液中 c(Ag+)=c(Cl-) |
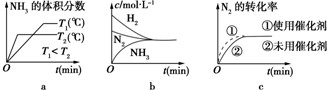
(2)已知反应N2+3H2?2NH3△H=a kJ•mol-1.试根据下表中所列键能数据估算a的数值为-93.
| 化学键 | H-H | N-H | N≡N |
| 键能kJ/mol | 436 | 391 | 945 |
已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应热化学方程式:2C (s,石墨)+H2(g)=C2H2(g)△H=+226.7kJ/mol.
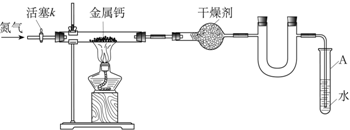
(1)按图连接好实验装置.检查装置气密性的方法是关闭活塞k,将末端导管插入试管A的水中,用酒精灯微热硬玻璃管,若导管末端有气泡冒出,撤去酒精灯冷却后,在导管内形成一段水柱,则证明装置的气密性良好.
(2)反应过程中末端导管必须插入试管A 的水中,目的是防止空气中的氧气通过末端导管进入实验装置,生成氧化钙,引入杂质
(3)制备氮化钙的操作步骤是:
①打开活塞k并通入N2;
②点燃酒精灯,进行反应;
③反应结束后
④拆除装置,取出产物.
(4)数据记录如下:
| 空硬玻璃管质量m0/g | 硬玻璃管与钙的质量m1/g | 硬玻璃管与产物的质量m2/g |
| 114.8 | 120.8 | 122.2 |
②若通入的N2中混有少量O2,如上计算得到的x3<3(填写“>”、“=”、“<”),判断依据
是:因为钙的总量不变,含有氧化钙的氮化钙总质量增大,钙与氮(不纯)元素的质量比减小,其个数比也变小,所以x值会减小.
| 实验编号 | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.10mL | 18.40mL |
| 第二次 | 3.00mL | 21.10mL |
| 第三次 | 0.20mL | 20.40mL |
| 第四次 | 0.00mL | 18.20mL |
(2)以下操作可能造成测定结果偏低的是B(填写序号).
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.滴定管在滴定前尖嘴处有气泡,滴定后消失
D.盛装未知液的锥形瓶用蒸馏水洗后,未用待测液润洗
E.未用标准液润洗碱式滴定管.
| A. | 使 SO3 的浓度增大 | B. | 使平衡向正反应方向移动 | ||
| C. | 使平衡常数 K 增大 | D. | 使正反应速率大于逆反应速率 |
| A. | 当电池负极消耗m g气体时,电解池阴极同时有m g气体生成 | |
| B. | 电池的正极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 电池中c(KOH)不变;电解池中溶液pH变大 | |
| D. | 电解后c(Na2CO3)不变,且溶液中有Na2CO3﹒10H2O晶体析出 |