题目内容
7.t℃时,将2mol SO2和1mol O2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g),2min时反应达到平衡,此时测得反应物O2还剩余0.8mol,请填写下列空白:(1)从反应开始到化学平衡,生成SO3的平均反应速率为0.1mol/(L.min);平衡时SO2转化率为20%.
(2)下列叙述能说明该反应已达到化学平衡状态的是ABE.
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2n mol SO2的同时消耗n mol O2
E.相同时间内消耗2n mol SO2的同时生成n mol O2
(3)t℃时,若将物质的量之比为1:1的SO2和O2混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%.SO2的转化率为80%.
分析 (1)2SO2(g)+O2(g)?2SO3(g),
开始(mol)2 1 0
反应(mol)0.4 0.2 0.4
平衡(mol)1.6 0.8 0.4
v(SO3)=$\frac{\frac{△n}{V}}{△t}$;平衡时SO2转化率=$\frac{反应的二氧化硫物质的量}{反应初始二氧化硫物质的量}$×100%;
(2)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
(3)t2℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,设二者起始物质的量均为1mol,反应达到平衡时,混合气体体积减少了20%,则气体物质的量减小2mol×20%=0.4mol,利用差量法计算参加反应二氧化硫的物质的量,进而计算SO2的转化率.
解答 解:(1)2SO2(g)+O2(g)?2SO3(g),
开始(mol)2 1 0
反应(mol)0.4 0.2 0.4
平衡(mol)1.6 0.8 0.4
v(SO3)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.4mol}{2L}}{2min}$=0.1mol/(L.min);平衡时SO2转化率=$\frac{反应的二氧化硫物质的量}{反应初始二氧化硫物质的量}$×100%=$\frac{0.4mol}{2mol}$×100%=20%,
故答案为:0.1mol/(L.min);20%;
(2)A.反应前后气体的物质的量减小,恒温恒容条件下,气体压强减小,当容器内压强不再发生变化时,正逆反应速率相等,反应达到平衡状态,故A正确;
B.反应前后二氧化硫的物质的量减少,则二氧化硫的体积分数减小,当SO2的体积分数不再发生变化
时正逆反应速率相等,反应达到平衡状态,故B正确;
C.无论反应是否达到平衡状态,容器内气体原子总数始终不变,不能据此判断平衡状态,故C错误;
D.无论反应是否达到平衡状态,都存在相同时间内消耗2n mol SO2的同时消耗n mol O2,则不能据此判断平衡状态,故D错误;
E.相同时间内消耗2n mol SO2的同时生成n mol O2,同时消耗nmol氧气,正逆反应速率相等,反应达到平衡状态,故E正确;
故选ABE;
(3)t2℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,设二者起始物质的量均为1mol,反应达到平衡时,混合气体体积减少了20%,则气体物质的量减小2mol×20%=0.4mol,
2SO2(g)+O2(g)?2SO3(g) 物质的量减小
2 2 1
0.8mol 0.8mol 0.4mol
故SO2的转化率=$\frac{0.8mol}{1mol}$×100%=80%,
故答案为:80%.
点评 本题考查化学平衡计算及化学平衡状态判断,为高频考点,侧重考查学生分析、判断及计算能力,注意:只有“反应前后改变的物理量”才能作为平衡状态的判断依据,难点是正确选取化学平衡状态的依据.

| A. | HOCH2CH2CH2OH | B. | CH2CH(OH)CH2OH | C. | CH2CH2OH | D. | HOCH2CH2OH |
| A. | 常温下,AgCl 在饱和 NaCl 溶液中的 KSP 比在纯水中的 KSP 小 | |
| B. | 向 AgCl 的悬浊液中加入 KI 溶液,沉淀由白色转化为黄色 | |
| C. | 将 0.001 mol•L-1 的 AgNO3 溶液滴入 KCl 和 KI 的混合溶液中,一定先产生 AgI 沉淀 | |
| D. | 向 AgCl 的饱和溶液中加入 NaCl 晶体,有 AgCl 析出且溶液中 c(Ag+)=c(Cl-) |
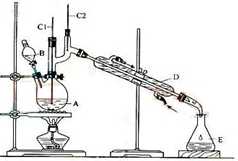 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.Na2Cr2O7H2SO4加热
发生的反应如下:
CH3CH2CH2CH2OH$\frac{\underline{\;\;\;Na_{2}Cr_{2}O_{7}\;\;\;}}{H_{2}SO_{4}加热}$ CH3CH2CH2CHO
反应物和产物的相关数据列表如表:
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.4g.回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由不能,浓硫酸溶于水会放出大量热,容易溅出伤人.
(2)加入沸石的作用是防止液体暴沸.若加热后发现未加沸石,应采取的正确方法是冷却后补加.
(3)装置图中,D仪器的名称是滴液漏斗,B仪器的名称是直形冷凝管,冷水从下进.(填上或下)
(4)分液漏斗使用前必须进行的操作是b(填正确答案标号).
a.润湿 b.检漏 c.干燥 d.标定
(5)将正丁醛粗产品置于分液漏斗中分层时,水在下 层(填“上”或“下”)
(6)本实验中,正丁醛的产率为62.5%.
(7)反应温度应保持在90-95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化.
(2)已知反应N2+3H2?2NH3△H=a kJ•mol-1.试根据下表中所列键能数据估算a的数值为-93.
| 化学键 | H-H | N-H | N≡N |
| 键能kJ/mol | 436 | 391 | 945 |
已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应热化学方程式:2C (s,石墨)+H2(g)=C2H2(g)△H=+226.7kJ/mol.
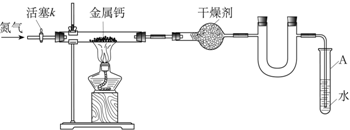
(1)按图连接好实验装置.检查装置气密性的方法是关闭活塞k,将末端导管插入试管A的水中,用酒精灯微热硬玻璃管,若导管末端有气泡冒出,撤去酒精灯冷却后,在导管内形成一段水柱,则证明装置的气密性良好.
(2)反应过程中末端导管必须插入试管A 的水中,目的是防止空气中的氧气通过末端导管进入实验装置,生成氧化钙,引入杂质
(3)制备氮化钙的操作步骤是:
①打开活塞k并通入N2;
②点燃酒精灯,进行反应;
③反应结束后
④拆除装置,取出产物.
(4)数据记录如下:
| 空硬玻璃管质量m0/g | 硬玻璃管与钙的质量m1/g | 硬玻璃管与产物的质量m2/g |
| 114.8 | 120.8 | 122.2 |
②若通入的N2中混有少量O2,如上计算得到的x3<3(填写“>”、“=”、“<”),判断依据
是:因为钙的总量不变,含有氧化钙的氮化钙总质量增大,钙与氮(不纯)元素的质量比减小,其个数比也变小,所以x值会减小.
| A. | 使 SO3 的浓度增大 | B. | 使平衡向正反应方向移动 | ||
| C. | 使平衡常数 K 增大 | D. | 使正反应速率大于逆反应速率 |
 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.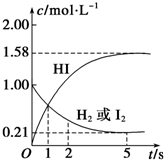 某温度时,向某V L的密闭容器中充入3molH2(g)和3mol I2(g),发生反应:
某温度时,向某V L的密闭容器中充入3molH2(g)和3mol I2(g),发生反应: