题目内容
10.乙二醇(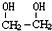 )是一种重要的化工原料,
)是一种重要的化工原料,Ⅰ.在一定条件下以CO和H2为原料可以合成乙二醇,反应方程式如下:
2CO(g)+3H2(g)?
 (g)△H=a kJ/mol
(g)△H=a kJ/mol(1)该反应能够自发进行,可以推出a<0;(填“>”“<”或“=”).
(2)在一定温度下,向体积为1L的恒容密闭容器中充入2mol CO (g)和3mol H2(g),压强为P1,达到平衡时压强变为P2,且P1:P2=15:7,则该温度下的化学平衡常数K=1.5
(3)只改变反应的一个条件,能使平衡体系中
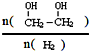 增大的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来(写两条)
增大的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来(写两条)Ⅱ.乙二醇经连续催化氧化后可得到乙二酸(HOOC-COOH),乙二酸俗称草酸,分子式可以用H2C2O4表示,H2C2O4是一种二元弱酸,常温下其电离平衡常数K1=5.0×10-2,K2=5.0×10-5
(1)H2C2O4的电离方程式为H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-.
(2)Na2C2O4溶液显碱性(填“酸性”、“中性”或“碱性”),溶液中各离子浓度从大到小的顺序为c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+).
(3)已知常温下NH3•H2O的电离平衡常数K=1.75×10-5,常温下,反应NH3•H2O+HC2O4-═NH4++C2O42-+H2O的平衡常数K=8.75×104.
分析 Ⅰ.(1)根据△G=△H-T△S<0,反应自发进行,据此判断;
(2)根据压强之比等于物质的量之比求得平衡时各物质的物质的量,进而求得浓度,根据平衡常数的定义进行计算;
(3)根据影响化学平衡的因素找使平衡正向移动的方法;
Ⅱ.(1)草酸是二元弱酸存在电离平衡,分步电离;
(2)Na2C2O4为强碱弱酸盐,草酸根水解,溶液呈碱性,一级水解程度大于二级水解程度;
(3)根据反应NH3•H2O+HC2O4-═NH4++C2O42-+H2O可知,平衡常数K=$\frac{c(N{{H}_{4}}^{+})•c({C}_{2}{{O}_{4}}^{2-})•c({H}_{2}O)}{c(N{H}_{3}•{H}_{2}O)•c(H{C}_{2}{{O}_{4}}^{-})}$=$\frac{c(N{{H}_{4}}^{+)}•c({C}_{2}{{O}_{4}}^{2-})•c({H}_{2}O)}{c(N{H}_{3}•{H}_{2}O)•c(H{C}_{2}{{O}_{4}}^{-})}$•$\frac{c(O{H}^{-})}{c(O{H}^{-})}$=$\frac{{k}_{2}•k(N{H}_{3}•{H}_{2}O)}{{k}_{W}}$计算.
解答 解:Ⅰ.(1)根据△G=△H-T△S<0,反应自发进行,该反应是个体积增大的反应,所以△S>0,则△H<0反应自发进行,
故答案为:<;
(2)设反应生成的乙二醇为x,利用三段式分析,
根据反应2CO(g)+3H2(g)? (g)
(g)
起始(mol/L) 2 3 0
转化(mol/L) 2x 3x x
平衡(mol/L)2-2x 3-3x x
由且P1:P2=15:7可得:$\frac{2+3}{2-2x+3-3x+x}$=$\frac{15}{7}$,解得x=$\frac{2}{3}$,所以平衡时CO、H2、 的浓度依次为:$\frac{2}{3}$mol/L、1mol/L、$\frac{2}{3}$mol/L,k=$\frac{2/3}{(2/3)^2×1^3}$=1.5;
的浓度依次为:$\frac{2}{3}$mol/L、1mol/L、$\frac{2}{3}$mol/L,k=$\frac{2/3}{(2/3)^2×1^3}$=1.5;
故答案为:1.5;
(3)使平衡体系中 增大,即平衡向正反应方程移动,该反应为气体体积减小的放热反应,所以可采取的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来;
增大,即平衡向正反应方程移动,该反应为气体体积减小的放热反应,所以可采取的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来;
故答案为:降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来;
Ⅱ.(1)由题知H2C2O4是一种二元弱酸,分步电离:H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-;
故答案为:H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-;
(2)H2C2O4是二元弱酸,Na2C2O4为强碱弱酸盐,草酸根水解,溶液呈碱性,一级水解程度大于二级水解程度,所以溶液中离子浓度大小关系 为c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+);
故答案为:碱性;c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+);
(3)根据反应NH3•H2O+HC2O4-═NH4++C2O42-+H2O可知,平衡常数k=$\frac{c(N{{H}_{4}}^{+})•c({C}_{2}{{O}_{4}}^{2-})•c({H}_{2}O)}{c(N{H}_{3}•{H}_{2}O)•c(H{C}_{2}{{O}_{4}}^{-})}$=$\frac{c(N{{H}_{4}}^{+})•c({C}_{2}{{O}_{4}}^{2-})•c({H}_{2}O)}{c(N{H}_{3}•{H}_{2}O)•c(H{C}_{2}{{O}_{4}}^{-})}$×$\frac{c(O{H}^{-})}{c(O{H}^{-})}$=$\frac{{k}_{2}•k(N{H}_{3}•{H}_{2}O)}{{k}_{W}}$=$\frac{1.75×1{0}^{-5}×5.0×1{0}^{-5}}{1.0×1{0}^{-14}}$=8.75×104;
故答案为:8.75×104.
点评 本题考查了弱电解质的电离、电离平衡溶液的计算、离子浓度大小比较、平衡移动的影响因素等,明确弱电解质电离特点及平衡常数的运用是解本题关键,难度中等.

| A. | 工业上可角电解法制备Mg:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+C12↑ | |
| B. | 用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+Fe2++14H+═2Cr3++Fe3++7H2O | |
| C. | 用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq) | |
| D. | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2═2HClO+CaCO3↓ |
| A. | 若AgNO3足量,AgCl和AgI都可沉淀,但以AgCl为主 | |
| B. | 两清液混合,AgCl和AgI都沉淀 | |
| C. | 若取0.1435 g AgCl固体放入100mL水(忽略体积变化),c(Cl-)为0.01 mol/L | |
| D. | 向AgI清液加入AgNO3,c(Ag+)增大,Ksp(AgI)也增大 |
| A. | 常温下,AgCl 在饱和 NaCl 溶液中的 KSP 比在纯水中的 KSP 小 | |
| B. | 向 AgCl 的悬浊液中加入 KI 溶液,沉淀由白色转化为黄色 | |
| C. | 将 0.001 mol•L-1 的 AgNO3 溶液滴入 KCl 和 KI 的混合溶液中,一定先产生 AgI 沉淀 | |
| D. | 向 AgCl 的饱和溶液中加入 NaCl 晶体,有 AgCl 析出且溶液中 c(Ag+)=c(Cl-) |
(2)已知反应N2+3H2?2NH3△H=a kJ•mol-1.试根据下表中所列键能数据估算a的数值为-93.
| 化学键 | H-H | N-H | N≡N |
| 键能kJ/mol | 436 | 391 | 945 |
已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应热化学方程式:2C (s,石墨)+H2(g)=C2H2(g)△H=+226.7kJ/mol.
| 实验编号 | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.10mL | 18.40mL |
| 第二次 | 3.00mL | 21.10mL |
| 第三次 | 0.20mL | 20.40mL |
| 第四次 | 0.00mL | 18.20mL |
(2)以下操作可能造成测定结果偏低的是B(填写序号).
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.滴定管在滴定前尖嘴处有气泡,滴定后消失
D.盛装未知液的锥形瓶用蒸馏水洗后,未用待测液润洗
E.未用标准液润洗碱式滴定管.
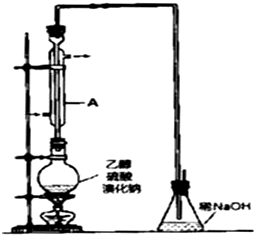 有机化工原料溴乙烷的沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是CH3CH2OH+HBr→CH3CH2Br+H2O.
有机化工原料溴乙烷的沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是CH3CH2OH+HBr→CH3CH2Br+H2O. 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.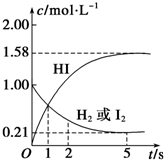 某温度时,向某V L的密闭容器中充入3molH2(g)和3mol I2(g),发生反应:
某温度时,向某V L的密闭容器中充入3molH2(g)和3mol I2(g),发生反应: