题目内容
15.下列各组物质中,依次属于单质、酸、盐的一组是( )| A. | 水、烧碱、食盐 | B. | 氧气、盐酸、熟石灰 | ||
| C. | 液氯、硝酸、纯碱 | D. | 干冰、石灰石、氧化钙 |
分析 单质是由同种元素组成的纯净物;酸是电离出来的阳离子全部是氢离子的化合物;盐是电离出金属离子(或铵根离子)和酸根离子的化合物;根据以上概念分析.
解答 解:A.水属于氧化物,烧碱即氢氧化钠属于碱,食盐属于盐,故A错误;
B.氧气属于单质;盐酸是氯化氢的水溶液属于混合物;熟石灰氢氧化钙属于碱,故B错误;
C.液氯是由氯元素组成的纯净物,属于单质;硝酸属于酸;纯碱碳酸钠属于盐,故C正确;
D.干冰属于氧化物;石灰石主要成分是碳酸钙为混合物,氧化钙属于氧化物,故D错误.
故选C.
点评 本题考查单质、酸、盐的概念辨析,难度不大,注意知识的积累.

练习册系列答案
相关题目
3.由甲醛、乙炔和苯组成的混合物中,测得含碳元素的质量分数为72%,则混合物中氢元素的质量分数为( )
| A. | 20.7% | B. | 22% | C. | 1.3% | D. | 7.3% |
10.下列实验中,对应的现象及结论都正确且存在因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 用酒精灯加热摩尔盐(NH4)2Fe(SO4)2•6H2O,产生的气体通过装有无水硫酸铜的干燥管 | 干燥管中的白色粉末先变成天蓝色,后又变成深蓝色 | 加热温度较低时摩尔盐分解产生水蒸气,温度稍高时分解产物中有氨气 |
| B | 向某溶液中滴加BaCl2溶液,随后加稀硝酸酸化 | 溶液中产生白色沉淀,加稀硝酸不溶解 | 原溶液中一定含有SO42- |
| C | 向CuSO4溶液中通入H2S气体 | 溶液的蓝色褪去,生成黑色沉淀 | 氢硫酸的酸性比硫酸强 |
| D | 向2ml0.1mol/LAgNO3溶液中先滴几滴0.1mol/L的NaCl溶液,再滴入几滴0.1mol/L的NaI溶液 | 先生成白色沉淀,后生成黄色沉淀 | 溶度积KSp(AgCl) >KSp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
20.NA表示阿伏伽德罗常数.下列说法正确的是( )
| A. | 18gNH4+含有质子的数目为10NA | |
| B. | 1molNa2O2与足量CO2反应时,转移电子的数目为2NA | |
| C. | 标准状况下,体积均为22.4L的O2、HCl、H2O含有的分子数目均为NA | |
| D. | 质量为16g的O2和O3的混合气体中所含氧原子的数目为NA |
7.在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质.下列现象与结论相等的是( )
| A. | 溶液呈黄绿色,且具有刺激性气味,说明Cl2的存在 | |
| B. | 加入有色布条,有色布条褪色,说明溶液中有Cl2存在 | |
| C. | 加入NaHCO3溶液,有无色气体产生,说明有HClO存在 | |
| D. | 先加入盐酸酸化,再加AgNO3溶液产生白色沉淀,说明有Cl-存在 |
4.用石墨作电极电解0.1mol•L-1的NaCl溶液,通电一段时间后发现两极收集的气体体积之比为4:3,下列说法正确的是( )
| A. | 在电解后的溶液中注入一定量的盐酸可以使溶液恢复到原始状态 | |
| B. | 在电解质溶液中通入标况下4.48L的氯化氢气体并注入0.1mol的水可以使溶液恢复到原始状态 | |
| C. | 阴极产生的气体的物质的量是阳极产生气体的物质的量的0.75倍 | |
| D. | 阳极产生的气体的平均摩尔质量为58g/mol |
5.“8.12”天津港爆炸事件原因是库存了大量硝酸铵、剧毒物氰化钠(NaCN)、金属钠和镁等化学品,下列说法正确的是( )
| A. | NaCN中碳元素的化合价为+4,是含碳的化合物,因此属于有机物 | |
| B. | 硝酸铵本身既具有氧化性又具有还原性,受热或撞击易发生爆炸 | |
| C. | 爆炸发生引发大火,可以用大量水灭火 | |
| D. | 为防止中毒,可用H2O2将NaCN还原为无毒物质 |
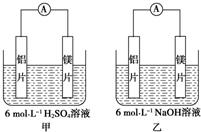 甲、乙两位学生想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol•L-1H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.
甲、乙两位学生想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol•L-1H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示. CF4
CF4 BaCl2
BaCl2 N2
N2 CO2
CO2 .
.