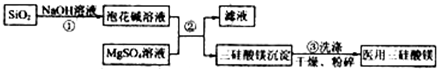
题目内容
6.请写出下列微粒的电子式KOH
 CF4
CF4 BaCl2
BaCl2 N2
N2 CO2
CO2 .
.
分析 氢氧化钾为离子化合物,电子式需要标出阴阳离子所带电荷;CF4是共价化合物,各原子满足稳定结构;BaCl2为离子化合物,由1个钡离子和2个氯离子构成;
氮气为单质,N原子之间为氮氮三键;二氧化碳为共价化合物,C原子和两个O原子间均为双键.
解答 解:氢氧化钾为离子化合物,由钾离子和氢氧根离子构成,氢氧化钾的电子式为: ;
;
CF4为共价化合物,各原子满足8电子稳定结构,电子式为 ;
;
BaCl2为离子化合物,由1个钡离子和2个氯离子构成,相同离子不能合并,故电子式为 ;
;
氮气为单质,N原子之间为共价键且为氮氮三键,故电子式为: ;
;
二氧化碳为共价化合物,C原子和两个O原子间均为双键,故二氧化碳的电子式为 .
.
故答案为: ;
; ;
; ;
; ;
; .
.
点评 本题考查了电子式的书写,题目难度不大,注意掌握电子式的正确表示方法,在书写电子式之前先判断物质的种类.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
17.测得某无色透明溶液的pH=2,则在该溶液中能大量共存的离子是( )
| A. | Na+ Cl- Mg2+ SO42- | B. | K+ Cu2+ I- SO42- | ||
| C. | NO3- K+ Cl- OH- | D. | Al3+ Na+ S2- Cl- |
14.下列化合物中含有手性碳原子的是( )
| A. | CCl2F2 | B. | 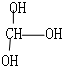 | C. | CH3CH2OH | D. | 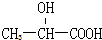 |
1.下列元素电负性最大的是( )
| A. | C | B. | F | C. | Cl | D. | N |
11.下列说法正确的是( )
| A. | CH2Cl2不存在同分异构体是甲烷正四面体结构的理由之一 | |
| B. |  和 和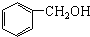 互为同系物 互为同系物 | |
| C. |  的系统命名的名称是1,2-二溴-2-环己烯 的系统命名的名称是1,2-二溴-2-环己烯 | |
| D. | 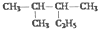 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 |
18.能说明氯元素的非金属性比硫元素强的事实是( )
①Cl2与H2S溶液发生置换反应
②受热时H2S能分解,HCl则不能
③单质硫可在空气中燃烧,Cl2不能
④HCl是强酸,H2S是弱酸.
①Cl2与H2S溶液发生置换反应
②受热时H2S能分解,HCl则不能
③单质硫可在空气中燃烧,Cl2不能
④HCl是强酸,H2S是弱酸.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
15.下列各组物质中,依次属于单质、酸、盐的一组是( )
| A. | 水、烧碱、食盐 | B. | 氧气、盐酸、熟石灰 | ||
| C. | 液氯、硝酸、纯碱 | D. | 干冰、石灰石、氧化钙 |
16.下列操作或装置能达到实验目的是( )
| A | B | C | D |
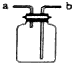 | 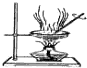 | 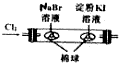 | 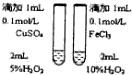 |
| 用该装置排空气法收集H2、CO2、Cl2等气体 | 蒸干AlCl3饱和溶液制备AlCl3晶体 | 可以证明氧化性Cl2>Br2>I2 | 比较不同催化剂对反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |