题目内容
8.下列说法正确的是( )①苯不能使溴水因反应而褪色证明没有碳碳双键?
②苯分子中碳碳之间的键长均相等证明苯分子无单双键交替结构?
③甲苯是苯的同系物,均不能使酸性高锰酸钾溶液褪色
④间二氯苯没有同分异构体证明了苯分子不是单双键交替
⑤硝基苯中含有苯、浓硝酸、浓硫酸杂质,除杂方法是向其中加入氢氧化钠溶液后分液.
| A. | ①②③ | B. | ②③ | C. | ①② | D. | ④⑤ |
分析 ①如果存在双键,能够使溴水褪色;
②碳碳单键键常与碳碳双键键长比相等;
③由于苯环对测链的影响,苯环上的甲基能够被高锰酸钾氧化;
④无论苯分子无单双键交替结构,间二甲苯都只有1种;
⑤苯不能与氢氧化钠反应.
解答 解:①如果苯是单双键交替结构,则苯应该能与溴水发生加成反应,苯不能因发生化学反应而使溴水溶液褪色说明不存在双键,故①正确;
②若苯是单双键交替结构,则碳碳键键长不同,而实际分子中碳碳之间的键长均相等证明苯分子无单双键交替结构?,故②正确;
③甲苯是苯的同系物,苯不能使酸性高锰酸钾溶液褪色,甲苯能够被酸性高锰酸钾氧化生成苯甲酸,故③错误;
④无论苯分子无单双键交替结构,间二甲苯都只有1种,所以间二氯苯没有同分异构体不能证明了苯分子不是单双键交替,故④错误;
⑤硝基苯中含有苯、浓硝酸、浓硫酸杂质,向其中加入氢氧化钠溶液后分液,只能出去浓硝酸、浓硫酸,不能除去苯,故⑤错误;
故选:C.
点评 本题考查了苯及其化合物,侧重考查苯的结构,明确苯环中碳碳双键的独特性是解题关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.对于A2(g)+3B2(g)═2C(g)+D(g)的反应来说,以下化学反应速率的表示中,反应速率最大的是( )
| A. | υ(A2)=0.4 mol•L-1•s-1 | B. | υ(B2)=0.8 mol•L-1•s-1 | ||
| C. | υ(C)=0.6 mol•L-1•s-1 | D. | υ(D)=0.6 mol•L-1•min-1 |
19.为提纯表中的物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是( )
| 编号 | 被提纯物质 | 除杂试剂 | 分离方法 |
| ① | 苯甲酸(不溶于水的杂质) | 水 | 过滤、重结晶 |
| ② | 乙酸乙酯(醋酸) | 氢氧化钠溶液 | 分液 |
| ③ | 乙醇(4%的水) | 生石灰 | 蒸馏 |
| ④ | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| A. | ①② | B. | ①③ | C. | ②③ | D. | ③④ |
16.下列变化属于吸热反应的是( )
| A. | 碘的升华 | B. | Ba(OH)2•8H2O与NH4Cl混合搅拌 | ||
| C. | 生石灰与水反应 | D. | 浓硫酸稀释 |
20.阅读下表短周期主族元素的相关系信息.
请回答:
(1)写出E在元素周期表中的位置:第二周期第ⅣA族;C的简单离子的结构示意图: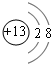 .
.
(2)X的化学式为NaClO.
(3)A、B、C三种元素的简单离子的半径由大到小的顺序为O2->Na+>Al3+(用离子符号表示).
(4)A、B两元素组成的化合物A2B2属于离子化合物(填“离子”或“共价”“化合物”).存在的化学键是离子键、共价键.
(5)C元素形成的单质能与A的最高价氧化物水合物反应,其离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的离子半径简单最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
(1)写出E在元素周期表中的位置:第二周期第ⅣA族;C的简单离子的结构示意图:
 .
.(2)X的化学式为NaClO.
(3)A、B、C三种元素的简单离子的半径由大到小的顺序为O2->Na+>Al3+(用离子符号表示).
(4)A、B两元素组成的化合物A2B2属于离子化合物(填“离子”或“共价”“化合物”).存在的化学键是离子键、共价键.
(5)C元素形成的单质能与A的最高价氧化物水合物反应,其离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
17.下列方程式书写完全正确的是( )
| A. | 苯酚钠溶液中通入过量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | 溴乙烷的消去反应:C2H5Br+OH-$→_{△}^{水}$C2H4↑+Br-+H2O | |
| C. | 乙醇催化氧化成乙醛:2C2H5OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O | |
| D. | 乙酸乙酯在碱性条件下水解:CH3COOC2H5+H2O?CH3COOH+C2H5OH |
18.元素的性质呈现周期性变化的根本原因是( )
| A. | 原子半径呈周期性变化 | |
| B. | 元素的化合价呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素原子的核外电子排布呈周期性变化 |
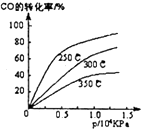 工业合成甲醇反应如下:CO(g)+2H2(g)?CH3OH(g);△H请回答下列问题:
工业合成甲醇反应如下:CO(g)+2H2(g)?CH3OH(g);△H请回答下列问题: .
.