题目内容
4.下列烷烃中,能由相应的烯烃与H2按物质的量1:1加成制得,并且烯烃的种类有两种的是( )| A. |  | B. |  | C. |  | D. |  |
分析 加成反应指有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应.根据加成原理采取逆推法还原C=C双键,烷烃分子中相邻碳原子上均带氢原子的碳原子间是对应烯烃存在碳碳双键的位置.
解答 解:A、 中在1号和2号碳原子间、2号和5号碳原子间可以存在双键,故A正确;
中在1号和2号碳原子间、2号和5号碳原子间可以存在双键,故A正确;
B、 中能存在双键的位置只有一个,故B错误;
中能存在双键的位置只有一个,故B错误;
C、 中只能在3号和4号碳原子之间可以存在双键,故C错误;
中只能在3号和4号碳原子之间可以存在双键,故C错误;
D、 中任何两个碳原子间均不能存在双键,故D错误.
中任何两个碳原子间均不能存在双键,故D错误.
故选A.
点评 本题考查根据烷烃判断相应的烯烃,难度较大,会根据烷烃结构去掉相邻氢原子形成碳碳双键.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
15.已知R2-离子的核内有n个中子,R的质量数为M,则mgR2-离子里含有电子的物质的量为( )
| A. | $\frac{m(M-n)}{M}$ | B. | $\frac{M-n+2}{Mm}$ | C. | $\frac{m(M-n+2)}{M}$ | D. | $\frac{m(M-n-2)}{M}$ |
19.研究物质的微观结构,有助于人们理解物质变化的本质.请回答下列问题:
(1)C、Si、N的电负性由大到小的顺序是N>C>Si.C60和金刚石都是碳的同素异形体,二者比较,熔点高的是金刚石.
(2)A、B均为短周期金属元素,依据如表数据,写出B的基态原子的电子排布式1S22S22P63S2.
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般地,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色.如[Co(H2O)6]2+显粉红色.据此判断,[Mn(H2O)6]2+有(填“无”或“有”)颜色.
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等.
①每个COCl2分子内含有3个σ键,1个π键.其中心原子采取SP2杂化轨道方式.
②配合物Fe(CO)5的配体是CO.
(1)C、Si、N的电负性由大到小的顺序是N>C>Si.C60和金刚石都是碳的同素异形体,二者比较,熔点高的是金刚石.
(2)A、B均为短周期金属元素,依据如表数据,写出B的基态原子的电子排布式1S22S22P63S2.
| 电离能 /(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等.
①每个COCl2分子内含有3个σ键,1个π键.其中心原子采取SP2杂化轨道方式.
②配合物Fe(CO)5的配体是CO.
9.下列实验设计不能达到实验目的是( )
| 选项 | 实验设计 | 实验目的 |
| A | 分别取大小相近的钠粒、钾粒投入水中,观察反应的剧烈程度 | 比较钠、钾元素的金属性强弱 |
| B | 将两块相同的铝片放入不同浓度的稀盐酸中,观察产生气泡的速率 | 验证H+的浓度是影响反应速率的唯一因素 |
| C | 将少量溴水加入碘化钾溶液中,再加入CCl4,振荡,静置,观察CCl4层颜色 | 比较溴单质和碘单质的氧化性性强弱 |
| D | 向硅酸钠溶液中加入稀硫酸,观察是否有 沉淀生成 | 比较硫元素和硅元素的非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
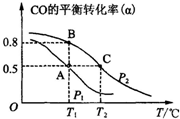 利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)?CH3OH(g).今在一容积可变的密闭容器中,充有10mol CO和20mol H2用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)?CH3OH(g).今在一容积可变的密闭容器中,充有10mol CO和20mol H2用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示: