题目内容
12.(1)在①NaCl、②NaOH、③N2、④H2S、⑤Na2O2中,只含有离子键的是①,只含有极性键的是④,既含离子键又含非极性共价键的是⑤.(2)写出下列物质的结构式:CO2O=C=ON2N≡NHClOH-O-Cl.
分析 金属阳离子和阴离子之间的化学键为离子键,一般盐、碱金属氧化物中含有离子键,非金属元素之间的化学键为共价键,其中相同非金属元素形成的为非极性共价键,不同非金属元素形成的为极性共价键,共用电子对用短线表示的式子,据此进行判断.
解答 解:(1)①NaCl为离子化合物,只含有离子键;
②NaOH为离子化合物,既含有离子键,又含有极性共价键;
③N2为非金属单质,只含有非极性共价键;
④H2S为共价化合物,只含有极性共价键;
⑤Na2O2为离子化合物,既含有离子键,又含有非极性共价键.
故答案为:①;④;⑤;
(2)CO2为共价化合物,电子式为 ,结构式为O=C=O,氮气的结构式为N≡N,HClO为共价化合物,电子式为
,结构式为O=C=O,氮气的结构式为N≡N,HClO为共价化合物,电子式为 ,所以结构式为H-O-Cl;
,所以结构式为H-O-Cl;
故答案为:O=C=O;N≡N;H-O-Cl.
点评 本题考查化学键的类型以及电子式的书写,题目难度不大,注意离子键与共价键的区别以及结构式式的书写方法.

练习册系列答案
相关题目
2.现有部分短周期元素的性质或原子结构如下表:
(1)元素X的一种同位素是测定文物的年代,这种同位素原子的符号是146C,元素Z的原子结构示意图为 ;
;
(2)写出 Y单质的一种用途用作半导体材料.
| 元素编号 | 元素的性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为固态,其氢化物的化学式为RH4 |
| Z | 第三周期的简单离子中半径最小 |
 ;
;(2)写出 Y单质的一种用途用作半导体材料.
20.下列说法中正确的是( )
| A. | 分子通式为CnH2n+2的两烷烃一定互为同系物 | |
| B. | 卤代烃发生水解反应一定生成醇 | |
| C. | 苯和甲苯都能被酸性KMnO4溶液氧化 | |
| D. | 烃类都能燃烧生成CO2和水 |
7.下列反应的离子方程式表示正确的是( )
| A. | H2O2溶液与酸性KMnO4溶液反应:2MnO4-+3H2O2+6H+═2Mn2++6H2O+4O2↑ | |
| B. | 向Fe(NO3)3溶液中加入过量的HI溶液:2 NO3-+8H++6I-═3I2+2NO↑+4H2O | |
| C. | 少量SO2通入碳酸钠溶液中:CO32-+SO2═CO2+S O32- | |
| D. | 0.01 mol•L-1 NH4Al(SO4)2溶液与0.02 mol•L-1 Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O |
1.有机化学中取代反应范畴很广,下列4个反应中,属于取代反应范畴的是( )
| A. | 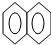 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$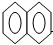 -NO2+H2O -NO2+H2O | |
| B. | CH3CH2CH2CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH2CH=CHCH3+H2O | |
| C. | CH3CHO+H2$→_{催化剂}^{高温高压}$CH3CH2OH | |
| D. | (CH3)2CHCH=CH2+HI→(CH3)2CHCHICH3 |
2.珍爱生命,远离毒品.以下是四种毒品的结构简式,下列有关说法正确的是( )
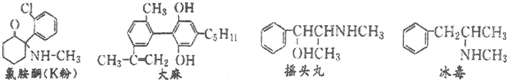

| A. | 四种毒品中都含有苯环,都属于芳香烃 | |
| B. | K粉的化学式为C13H15ONCl | |
| C. | 摇头丸经过消去反应、加成反应可制取冰毒 | |
| D. | 1mol大麻与溴水反应最多消耗4molBr2 |
 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: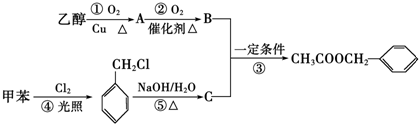
 .
. ;
; .
.


