题目内容
15.已知R2-离子的核内有n个中子,R的质量数为M,则mgR2-离子里含有电子的物质的量为( )| A. | $\frac{m(M-n)}{M}$ | B. | $\frac{M-n+2}{Mm}$ | C. | $\frac{m(M-n+2)}{M}$ | D. | $\frac{m(M-n-2)}{M}$ |
分析 R2-的核内有n个中子,R的质量数为M,则质子数为M-n,阴离子中,质子数+所带电荷数=核外电子数,据此计算该阴离子的核外电子数,再利用质量和质量数计算原子的物质的量,进而计算该阴离子的电子数.
解答 解:由R2-的核内有n个中子,R的质量数为M,则质子数为M-n,故R2-阴离子的核外电子数为M-n+2,mg R2-的物质的量$\frac{m}{M}$mol,所以mgR2-阴离子含有的电子的物质的量为$\frac{m}{M}$mol×(M-n+2)=$\frac{m(M-n+2)}{M}$mol.
故选C.
点评 本题考查学生利用原子构成的简单计算,明确原子的物质的量的计算是解答本题的关键,注意电子的质量可忽略,质量数近似等于相对原子质量.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
20.下列说法中正确的是( )
| A. | 分子通式为CnH2n+2的两烷烃一定互为同系物 | |
| B. | 卤代烃发生水解反应一定生成醇 | |
| C. | 苯和甲苯都能被酸性KMnO4溶液氧化 | |
| D. | 烃类都能燃烧生成CO2和水 |
7.下列反应的离子方程式表示正确的是( )
| A. | H2O2溶液与酸性KMnO4溶液反应:2MnO4-+3H2O2+6H+═2Mn2++6H2O+4O2↑ | |
| B. | 向Fe(NO3)3溶液中加入过量的HI溶液:2 NO3-+8H++6I-═3I2+2NO↑+4H2O | |
| C. | 少量SO2通入碳酸钠溶液中:CO32-+SO2═CO2+S O32- | |
| D. | 0.01 mol•L-1 NH4Al(SO4)2溶液与0.02 mol•L-1 Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O |
5.下列中和反应中放出热量最多的是( )
| A. | 100 mL 0.3 mol/L 的HCl 和50 mL 0.3 mol/L 的NaOH相混合 | |
| B. | 80mL 0.3 mol/L 的HCl 和80 mL 0.3 mol/L 的NaOH溶液相混合 | |
| C. | 80mL 0.3 mol/L 的H2SO4 和80 mL 0.3 mol/L 的NaOH溶液相混合 | |
| D. | 50mL 0.3 mol/L 的H2SO4 和50 mL 0.6 mol/L 的NaOH溶液相混合 |
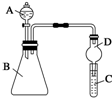 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.