题目内容
6.己知反应:①PbO2+4HCI═PbCl2+C12↑+2H20,②Cu+2Fe3+═Cu2++2Fe2+,③Cl2+2Fe2+═2Cl-+2Fe3+.则有关物质(离子)的氧化性由强到弱的顺序为( )| A. | Cl2>Fe3+>Cu2+>PbO2 | B. | PbO2>Cl2>Fe3+>Cu2+ | ||
| C. | Fe3+>Cu2+>PbO2>Cl2 | D. | Cu2+>Fe3+>Cl2>PbO2 |
分析 自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,据此分析解答.
解答 解:①PbO2+4HCl═PbCl2+Cl2↑+2H2O 中Pb元素化合价由+4价变为+2价、Cl元素化合价由-1价变为0价,所以 PbO2是氧化剂、Cl2是氧化产物,氧化性PbO2>Cl2;
②Cu+2Fe3+═Cu2++2Fe2+中Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,所以Fe3+是氧化剂、Cu2+是氧化产物,则氧化性Fe3+>Cu2+;
③2Fe2++C12=2Fe3++2C1-中Fe元素化合价由+2价变为+3价、Cl元素化合价由0价变为-1价,所以Cl2是氧化剂、Fe3+是氧化产物,则氧化性Cl2>Fe3+;
通过以上分析知,氧化性强弱顺序是PbO2>Cl2>Fe3+>Cu2+,
故选B.
点评 本题考查氧化性强弱判断方法,明确氧化性、还原性判断方法即可解答,会正确判断氧化剂、氧化产物是解本题关键,知道常见元素化合价,题目难度不大.

练习册系列答案
相关题目
16.下列设计的实验方案能达到实验目的是( )
| A. | 检验蔗糖是否水解:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察现象 | |
| B. | 检验溶液中是否含有NH4+:取少量待检验溶液,向其中加入浓NaOH溶液加热,再用湿润的红色石蕊试纸放置试管口,观察现象 | |
| C. | 提纯含有少量苯酚的苯:向含有少量苯酚的苯加入过量浓溴水,振荡后静置过滤,除去三溴苯酚沉淀 | |
| D. | 探究化学反应的限度:取5mL0.1mol/LKI溶液,滴加0.1mol/LFeCl3溶液5~6滴,充分反应,根据溶液中是否含有碘单质和碘离子判断该反应有一定限度 |
14.下列反应中,属于吸热反应的是( )
| A. |  | B. | 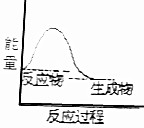 | ||
| C. | 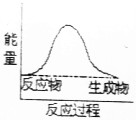 | D. | 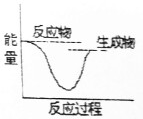 |
1. 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 该反应为放热反应 | |
| B. | 该反应的反应热等于E1-E2 | |
| C. | 催化剂能改变该反应的焓变 | |
| D. | 逆反应的活化能大于正反应的活化能 |
15.四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法不正确的是( )
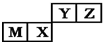

| A. | 原子半径:M>X>Y>Z | |
| B. | M的氯化物是弱电解质 | |
| C. | X的最简单气态氢化物的热稳定性比Z的小 | |
| D. | 简单离子的半径M小于Z |
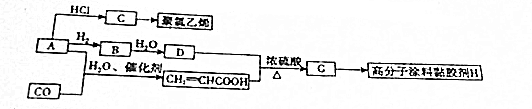
 ,A→C的反应类型:加成反应.
,A→C的反应类型:加成反应.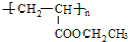 ,写出D的同分异构体的结构简式:CH3OCH3.
,写出D的同分异构体的结构简式:CH3OCH3. 某化学兴趣小组在实验室用如下装置制备氯气.
某化学兴趣小组在实验室用如下装置制备氯气.