题目内容
6.已知还原性SO32->I-,某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该无色溶液中加入少量溴水,溶液仍无色.则下列关于该溶液组成的判断正确的是( )| A. | 肯定不含I- | B. | 可能不含Cu2+ | C. | 可能含有SO32- | D. | 以上结论都不对 |
分析 溶液是无色溶液,说明一定不含Cu2+,向该无色溶液中加入少量溴水,溴水褪色,溶液呈无色,由于离子还原性SO32->I-,说明溶液中可以含I-,但一定含有还原性离子被溴单质氧化,判断一定含有SO32-,以此来解答.
解答 解:溶液是无色溶液,说明一定不含Cu2+,向该无色溶液中加入少量溴水,溴水褪色,溶液呈无色,由于离子还原性SO32->I-,说明溶液中可以含I-,但一定含有还原性离子被溴单质氧化,判断一定含有SO32-;分析判断可知,溶液中一定含有SO32-,一定不含Cu2+,可能含有I-,电荷守恒可知铵根离子一定存在;
A.溶液中可以含有I-,故A错误;
B.溶液是无色,肯定不含Cu2+,故B错误;
C.原溶液中一定含有SO32-,故C错误;
D.A、B、C的结论均错误,故D正确;
故选D.
点评 本题考查常见离子的检验,为高频考点,把握离子的颜色、发生的氧化还原反应为解答的关键,侧重分析与应用能力的考查,注意电荷守恒的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.下列微粒的结构示意图中氧族元素原子结构示意图的是( )
| A. |  | B. |  | C. |  | D. |  |
14.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 4.0 g重水(D2O)中所含质子数为2NA | |
| B. | 4.48 L N2与CO的混合物中所含分子数为0.2NA | |
| C. | 常温常压下16g的氧气与臭氧混合气体中,氧原子数为NA | |
| D. | 12.5 mL 16 mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
1.以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料可制备金属镁和溴.流程如图1:
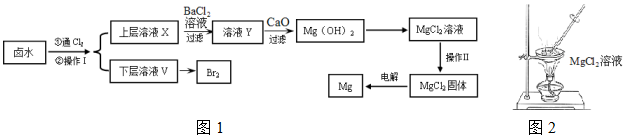
(1)操作Ⅰ的名称是萃取分液,所用主要玻璃仪器的名称是分液漏斗、烧杯;需要选择的试剂是c(填序号).
a.乙醇 b.苯 c.四氯化碳 d.裂化汽油
(2)通氯气反应的离子方程式Cl2+2Br-=2Cl-+Br2.
(3)证明SO42-完全沉淀的方法是静置向上层清液中继续加入BaCl2溶液,若不产生白色沉淀则证明SO42-已沉淀完全.
(4)CaO用来调节溶液Y的pH,可以使Mg2+沉淀完全,由表中数据可知,理论上应控制pH范围是11.0<pH<12.2.
(5)操作Ⅱ用图2所示操作不能实现(填“能”或“不能”).原因是MgCl2+2H2O?Mg(OH)2+2HCl(用化学方程式解释).
(6)工业上用惰性电极电解熔融状态下的氯化镁来冶炼镁,不能直接电解氯化镁溶液的原因是Mg2++2H2O+2Cl-$\frac{\underline{\;通电\;}}{\;}$Mg(OH)2↓+H2↑+Cl2↑(用离子方程式表示).
(7)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量NH4Cl晶体,充分振荡后浊液会变澄清,请用化学平衡的原理解释浊液变澄清的原因Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),NH4Cl电离出的NH4+与OH?结合成弱电解质一水合氨,降低了c(OH-),Mg(OH)2溶解平衡向右移动.

(1)操作Ⅰ的名称是萃取分液,所用主要玻璃仪器的名称是分液漏斗、烧杯;需要选择的试剂是c(填序号).
a.乙醇 b.苯 c.四氯化碳 d.裂化汽油
(2)通氯气反应的离子方程式Cl2+2Br-=2Cl-+Br2.
(3)证明SO42-完全沉淀的方法是静置向上层清液中继续加入BaCl2溶液,若不产生白色沉淀则证明SO42-已沉淀完全.
(4)CaO用来调节溶液Y的pH,可以使Mg2+沉淀完全,由表中数据可知,理论上应控制pH范围是11.0<pH<12.2.
| 开始沉淀时 | 沉淀完全时 | |
| Mg2+ | pH=9.6 | pH=11.0 |
| Ca2+ | pH=12.2 | c(OH-)=1.8mol/L |
(6)工业上用惰性电极电解熔融状态下的氯化镁来冶炼镁,不能直接电解氯化镁溶液的原因是Mg2++2H2O+2Cl-$\frac{\underline{\;通电\;}}{\;}$Mg(OH)2↓+H2↑+Cl2↑(用离子方程式表示).
(7)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量NH4Cl晶体,充分振荡后浊液会变澄清,请用化学平衡的原理解释浊液变澄清的原因Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),NH4Cl电离出的NH4+与OH?结合成弱电解质一水合氨,降低了c(OH-),Mg(OH)2溶解平衡向右移动.
11.现有X、Y、Z、W四种短周期元素,X、Y位于同主族,Z、W位于同主族且Z的核电荷数是W的2倍,Y、Z位于同周期,X与Z、W都不在同一周期.下列说法不正确的是( )
| A. | 简单离子半径:Z>W>Y | |
| B. | 气态氢化物的稳定性:Z<W | |
| C. | Z的氢化物能与其最高价氧化物对应的水化物反应 | |
| D. | 在X2和W2构成的燃料电池中,W2作负极 |




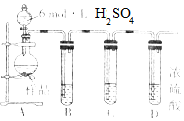 亚硫酸钠在存放过程中会因为被氧化而变质,某研究性学习小组的同学对一种亚硫酸钠样品是否变质及变质程度进行了探究.
亚硫酸钠在存放过程中会因为被氧化而变质,某研究性学习小组的同学对一种亚硫酸钠样品是否变质及变质程度进行了探究.