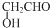题目内容
16.写出Fe2+的最高能层的电子排布式:3s23p63d6.将Fe2O3、KNO3、KOH混合加热共融可制取绿色净水剂K2FeO4,其中KNO3被还原为KNO2,写出该反应的化学方程式Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O.分析 根据Fe原子的核外电子排布式确定未成对电子数,失去2个电子变为亚铁离子;将Fe2O3、KNO3、KOH混合加热共融可制取绿色净水剂K2FeO4,其中KNO3被还原为KNO2,同时还生成KNO2和H2O,依据化学方程式的书写原则,原子守恒,氧化还原反应的化合价升降总数相同进行相等.
解答 解:26号元素Fe基态原子核外电子排布式为1s22s22p63s23p63d64s2,基态Fe原子核外处在能量最高的能级为3d,排布了6个电子,有6种不同的运动状态,可知在3d上存在4个未成对电子,失去2个电子变为亚铁离子,亚铁离子的电子排布式为1s22s22p63s23p63d6,故最高能层的电子排布式为:3s23p63d6;
将Fe2O3、KNO3、KOH混合加热共融可制取绿色净水剂K2FeO4,其中KNO3被还原为KNO2,同时还生成KNO2和H2O,配平得到化学方程式为:Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O;
故答案为:3s23p63d6;Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O.
点评 本题考查原子核外电子排布规律的运用和化学方程式的书写,难度不大,注意氧化还原反应的配平.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
6.下列说法正确的是( )
| A. | 常温下,加水稀释0.01mol•L-1的氨水,c(NH4+)•c(OH-)逐渐增大 | |
| B. | 在H2SO3溶液中滴加少量NaClO溶液,c(SO32-)逐渐增大 | |
| C. | 在H2S溶液中滴加CuSO4溶液,H2S的电离程度逐渐增大 | |
| D. | 微热醋酸溶液,$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$保持不变 |
7.某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示.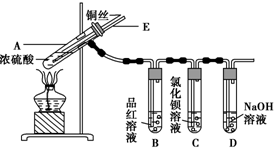
实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液褪色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面.
请回答下列问题:
(1)A试管中发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)能够证明铜与浓硫酸反应生成气体的实验现象是B试管中品红溶液褪色.
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置.
写出其中SO2表现还原性的离子反应方程式:SO2+Cl2+2H2O=4H++SO42-+2Cl-(或Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-).
(4)实验完毕后,先熄灭酒精灯,由于导管E的存在,试管B中的液体不会倒吸入试管A中,其原因是当A试管内气体压强减小时,空气从E导管进入A试管中,维持A试管中压强平衡.
(5)实验完毕后,装置中残留的气体有毒,不能打开导管上的胶塞.为了防止该气体排入空气中污染环境,拆除装置前,应当采取的操作是从E导管口向A试管中缓慢地鼓入足量的空气,将残留的SO2气体赶入NaOH溶液中,使之被完全吸收.
(6)将SO2气体通入含有n mol Na2S的溶液中,充分反应后,溶液中出现黄色浑浊,试分析该溶液最多能吸收SO2气体2.5n mol(不考虑溶解的SO2).

实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液褪色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面.
请回答下列问题:
(1)A试管中发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)能够证明铜与浓硫酸反应生成气体的实验现象是B试管中品红溶液褪色.
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置.
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
(4)实验完毕后,先熄灭酒精灯,由于导管E的存在,试管B中的液体不会倒吸入试管A中,其原因是当A试管内气体压强减小时,空气从E导管进入A试管中,维持A试管中压强平衡.
(5)实验完毕后,装置中残留的气体有毒,不能打开导管上的胶塞.为了防止该气体排入空气中污染环境,拆除装置前,应当采取的操作是从E导管口向A试管中缓慢地鼓入足量的空气,将残留的SO2气体赶入NaOH溶液中,使之被完全吸收.
(6)将SO2气体通入含有n mol Na2S的溶液中,充分反应后,溶液中出现黄色浑浊,试分析该溶液最多能吸收SO2气体2.5n mol(不考虑溶解的SO2).
4. 分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )
分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )
 分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )
分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )| A. | 9种 | B. | 10种 | C. | 12种 | D. | 15种 |
11.短周期主族元素A、B、C、D的原子序数依次增大.已知A、C的原子序数之差为8,A、B、C三种元素原子的最外层电子数之和为15,B元素原子的最外层电子数等于A元素原子的最外层电子数的一半,下列叙述正确的是( )
| A. | 简单离子的半径:B>C>D>A | |
| B. | 氢化物的稳定性:C>D | |
| C. | A与C形成的化合物溶于水所得溶液显碱性 | |
| D. | B与D形成的化合物溶于水所得溶液显酸性 |
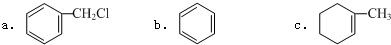
8.下列物质互为同分异构体的是( )
| A. | ${\;}_{1}^{1}$H2O和${\;}_{1}^{2}$H2O | B. | 乙烯和丙烯(CH2=CHCH3) | ||
| C. | 石墨和C60 | D. | 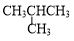 和CH3CH2CH2CH3 和CH3CH2CH2CH3 |
 太阳能电池又称为“光电池”,是一种利用太阳光直接发电的光电半导体薄片.该半导体薄片的主要成分是( )
太阳能电池又称为“光电池”,是一种利用太阳光直接发电的光电半导体薄片.该半导体薄片的主要成分是( )