题目内容
6.下列说法正确的是( )| A. | 常温下,加水稀释0.01mol•L-1的氨水,c(NH4+)•c(OH-)逐渐增大 | |
| B. | 在H2SO3溶液中滴加少量NaClO溶液,c(SO32-)逐渐增大 | |
| C. | 在H2S溶液中滴加CuSO4溶液,H2S的电离程度逐渐增大 | |
| D. | 微热醋酸溶液,$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$保持不变 |
分析 A.常温下,加水稀释促进一水合氨电离,但一水合氨电离增大程度小于溶液体积增大程度,所以溶液中c(NH4+)、c(OH-)都减小;
B.在H2SO3溶液中滴加少量NaClO溶液,二者发生氧化还原反应生成Cl-、SO42-;
C.硫化氢存在电离平衡H2S?HS-+H+、HS-?H++S2-,在H2S溶液中滴加CuSO4溶液,发生反应H2S+Cu2+=CuS↓+2H+;
D.弱电解质的电离是吸热反应,升高温度促进醋酸电离.
解答 解:A.常温下,加水稀释促进一水合氨电离,但一水合氨电离增大程度小于溶液体积增大程度,所以溶液中c(NH4+)、c(OH-)都减小,导致c(NH4+)•c(OH-)逐渐减小,故A错误;
B.在H2SO3溶液中滴加少量NaClO溶液,二者发生氧化还原反应生成Cl-、SO42-,导致溶液中c(SO32-)逐渐减小,故B错误;
C.硫化氢存在电离平衡H2S?HS-+H+、HS-?H++S2-,在H2S溶液中滴加CuSO4溶液,发生反应H2S+Cu2+=CuS↓+2H+,H2S的电离程度逐渐增大,故C正确;
D.弱电解质的电离是吸热反应,升高温度促进醋酸电离,所以醋酸电离平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$增大,故D错误;
故选C.
点评 本题考查弱电解质的电离,为高频考点,涉及弱电解质的电离、氧化还原反应、复分解反应等知识点,明确弱电解质电离特点是解本题关键及发生的反应是解本题关键,注意:电离平衡常数只与温度有关,与溶液浓度无关,易错选项是BC.

练习册系列答案
相关题目
19.乙醇(C2H6OH)和二甲醚(CH3OCH3)互为同分异构体且二甲醚不与钠反应,仅含碳,氢,氧三种元素的某化合物,其相对分子质量小于100,且氧的质量分数为18.18%.已知该化合物不与钠反,则该化合物的结构共有(不考虑立体异构)( )
| A. | 2种 | B. | 5种 | C. | 6种 | D. | 8种 |
17.草酸二甲酯的水解产物草酸(H2C2O4)为二元弱酸.已知:
(1)草酸氢钾溶液中c(H+)>(填“>”“<”或“=”)c(OH-).
(2)向0.1mol•L-1的草酸氢钾溶液中滴加NaOH溶液至溶液呈中性,此时溶液中各粒子的浓度关系正确的是ad(填字母).
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)
b.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
c.cNa+)=c(H2C2O4)+c(C2O42-)
d.c(K+)>cNa+)
(3)在浓度为1mol•L-1的HF与0.01mol•L-1的KHC2O4-混合溶液中逐滴加入1mol•L-1的CaCl2溶液,最初得到的沉淀为CaF2(填化学式).
| 难溶物 | CaF2 | CaC2O4 |
| Ksp | 3.5×10-11 | 2.3×10-9 |
| 酸 | HF | H2C2O4 |
| 电离常数 | Ka=7.2×10-4 | Ka1=5.4×10-2 Ka2=5.4×10-5 |
(2)向0.1mol•L-1的草酸氢钾溶液中滴加NaOH溶液至溶液呈中性,此时溶液中各粒子的浓度关系正确的是ad(填字母).
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)
b.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
c.cNa+)=c(H2C2O4)+c(C2O42-)
d.c(K+)>cNa+)
(3)在浓度为1mol•L-1的HF与0.01mol•L-1的KHC2O4-混合溶液中逐滴加入1mol•L-1的CaCl2溶液,最初得到的沉淀为CaF2(填化学式).
14.下列各组物质中,互为同分异构体的是( )
| A. | 石墨和富勒烯 | B. | H2O和H2O2 | C. | 1H 和 2H | D. | 乙醇和二甲醚 |
1.用铝灰(含有Al2O3、FeO、Fe203和少最SiO2)来的制备碱式硫酸铝[Al2(OH)4SO4],其工艺流程如下:
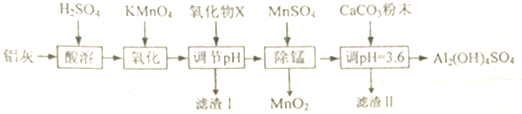
已知:生成氢氧化物沉淀的pH
(1)X为氧化铝,滤渣I的主要成分是二氧化硅和氢氧化铁,MnS04在“除锰”中的作用是还原剂
(2)设计一个简单的实验,证明上述流程中铁元素已被沉淀完全取第一次调节PH后的清液于试管中,滴加硫氰化钾溶液,若溶液呈血红色,说明沉淀不完全,反之沉淀完全
(3)写出第一次调节pH的范围[2.8,3.4),第二次调节pH时,若溶液的pH偏高,将会导致溶液中铝元素的含量降低
(4)加入CaC03制备碱式硫酸铝的化学方程式为Al2(SO4)3+2CaC03+2H2O=Al2(OH)4SO4+2CaSO4+2C02↑.

已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(2)设计一个简单的实验,证明上述流程中铁元素已被沉淀完全取第一次调节PH后的清液于试管中,滴加硫氰化钾溶液,若溶液呈血红色,说明沉淀不完全,反之沉淀完全
(3)写出第一次调节pH的范围[2.8,3.4),第二次调节pH时,若溶液的pH偏高,将会导致溶液中铝元素的含量降低
(4)加入CaC03制备碱式硫酸铝的化学方程式为Al2(SO4)3+2CaC03+2H2O=Al2(OH)4SO4+2CaSO4+2C02↑.
18.在光照条件下,CH4能与Cl2发生取代反应.若1mol CH4与一定的量的Cl2完全反应,反应后有四种取代产物生成,且四种产物物质的量相等,则消耗的Cl2为( )
| A. | 4 mol | B. | 2.5 mol | C. | 2 mol | D. | 0.5 mol |
15.基因测序研究中,常用${\;}_{15}^{32}$P作标记物,下列关于${\;}_{15}^{32}$P的说法正确的是( )
| A. | 质子数为32 | B. | 质量数为15 | ||
| C. | ${\;}_{15}^{32}$P与${\;}_{15}^{33}$P互为同位素 | D. | 中子数为15 |