题目内容
14.由10g含有杂质的CaCO3和足量盐酸反应,产生了0.1molCO2,推断杂质的组成可能是( )| A. | KHCO3和MgCO3 | B. | K2CO3和Na2CO3 | C. | MgCO3和Na2CO3 | D. | KHCO3和NaHCO3 |
分析 纯净的CaCO310g和足量的盐酸反应能产生了0.1mol的CO2,有杂质时也是如此,说明杂质中一种碳的含量高于碳酸钙,另一种低于碳酸钙,据此分析解答.
解答 解:纯净的CaCO310g 和足量的盐酸反应能产生了0.1mol的CO2,有杂质时也是如此,说明杂质中一种碳的含量高于碳酸钙,另一种低于碳酸钙,如果化学式中C原子个数都是1,则只要一种碳酸盐或碳酸氢盐的摩尔质量大于碳酸钙、一种小于碳酸钙即可,
A.根据化学式知,MgCO3和KHCO3中C的含量都大于碳酸钙,不符合条件,故A不选;
B.根据化学式知,K2CO3和Na2CO3中C的含量都小于碳酸钙,不符合条件,故B不选;
C.根据化学式知,Na2CO3中C的含量低于碳酸钙、MgCO3中C的含量高于碳酸钙,符合条件,故C选;
D.KHCO3中含C元素与碳酸钙相等,和NaHCO3的含量高于碳酸钙,不符合条件,故D不选;
故选C.
点评 本题考查化学方程式的计算,侧重考查分析能力,明确碳含量与生成二氧化碳的关系是解本题关键,利用碳含量进行计算即可,题目难度不大.

练习册系列答案
相关题目
4.砹是原子序数最大的卤族元素、根据卤素性质的递变规律,对砹及其化合物的叙述,正确的是( )
| A. | 与H2化合能力:At2>I2 | B. | 砹在常温下为白色固体 | ||
| C. | 砹原子的最外电子层上有7个电子 | D. | 砹能从NaCl溶液中置换出氯单质 |
5.化学与人类关系密切.下列有关物质的用途及其解释的说法正确的是( )
| 物质用途 | 解释 | |
| A | 食醋浸泡水壶中的水垢 | 水垢中CaCO3溶于醋酸,酸性H2CO3>CH3COOH |
| B | 炒菜时加一点酒和醋 | 有酯类物质生成,使菜味香可口 |
| C | NaClO溶液可用作洗手液 | NaClO具有杀菌、消毒作用 |
| D | Al2O3可用作医药中的胃酸中和剂 | Al2O3能与胃酸反应,使胃液酸度降低 |
| A. | A | B. | B | C. | C | D. | D |
3.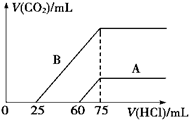 (1)取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:
(1)取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:
①原NaOH溶液的物质的量浓度为0.75mol/L.
②曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是Na2CO3、NaOH,其物质的量之比为1:3.
③曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为112mL.
(2)现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液.现分别将一定体积的甲、乙两溶液混合,具体情况如下表所示,请回答:
①甲瓶溶液为AlCl3溶液.
②乙瓶溶液的物质的量浓度为0.5mol/L.
 (1)取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:
(1)取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:①原NaOH溶液的物质的量浓度为0.75mol/L.
②曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是Na2CO3、NaOH,其物质的量之比为1:3.
③曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为112mL.
(2)现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液.现分别将一定体积的甲、乙两溶液混合,具体情况如下表所示,请回答:
| 实验① | 实验② | 实验③ | |
| 取甲瓶溶液的量 | 400mL | 120mL | 120mL |
| 取乙瓶溶液的量 | 120mL | 440mL | 400mL |
| 生成沉淀的量 | 1.56g | 1.56g | 3.12g |
②乙瓶溶液的物质的量浓度为0.5mol/L.
4.天津“8.12“爆炸中扩散的CN-造成部分水体污染.某小组欲检测污水中CN-的浓度并模拟电化学法除去CN-.
探究I 检测CN-浓度
资料:碱性条件下发生离子反应:2CN-+5H202+90H-═2CO32-+N2+6H20
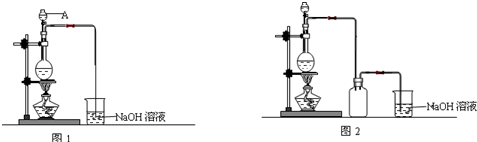
实验装置如图1(其中加热、夹持装置省略).(不考虑污水中其它离子反应)
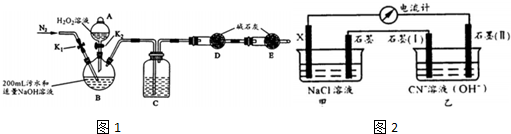
(1)加入药品之前的操作是检查装置气密性;C中试剂是浓H2S04
(2)实验步骤如下:
(3)计算CN-的浓度,需称得的质量是反应前后D装置的质量.
(4)为了使检测更加准确,上述(2)中操作要特别注意一些事项.请写出至少一条加稀H2S04时要缓慢注入(要缓慢通人N2或给B加热时温度不能过高或加入稀H2SO4,要足量).
探究Ⅱ电化学法处理CN-的影响因素由如图2装置模拟电化学法实验,有关结果如表.
(5)根据表格信息分析.
①X电极名称:负极;
②实验(1)中X换成Zn,则电流计读数的范围为I~1.5I
③若乙装置中阳极产生无毒无害物质,其电极方程式为2CN-+12OH--10e-=2CO32-+N2+6H2O;该实验说明电化学法处理CN-,影响处理速率的因素有负极的金属材料和甲中电解质的浓度(至少两条).
探究I 检测CN-浓度
资料:碱性条件下发生离子反应:2CN-+5H202+90H-═2CO32-+N2+6H20
实验装置如图1(其中加热、夹持装置省略).(不考虑污水中其它离子反应)

(1)加入药品之前的操作是检查装置气密性;C中试剂是浓H2S04
(2)实验步骤如下:
| 步骤1 | 关闭K1,打开K2,滴入足量H2O2溶液,对B加热.充分反应后,停止加热 |
| 步骤2 | 关闭K2,用注射器穿过B装置的胶塞注入 稀H2S04溶液 |
| 步骤3 | 打开K1,通入N2 |
(4)为了使检测更加准确,上述(2)中操作要特别注意一些事项.请写出至少一条加稀H2S04时要缓慢注入(要缓慢通人N2或给B加热时温度不能过高或加入稀H2SO4,要足量).
探究Ⅱ电化学法处理CN-的影响因素由如图2装置模拟电化学法实验,有关结果如表.
| 实验序号 | 电极(X) | NaCl溶液浓度 (mol/L) | 甲中石墨表面通入气体 | 电流计读数 (A) |
| (1) | Fe | 0.1 | 空气 | I |
| (2) | Al | 0.1 | 空气 | 1.5I |
| (3) | Fe | 0.1 | O2 | 2I |
| (4) | Al | 0.5 | 空气 | 1.6I |
①X电极名称:负极;
②实验(1)中X换成Zn,则电流计读数的范围为I~1.5I
③若乙装置中阳极产生无毒无害物质,其电极方程式为2CN-+12OH--10e-=2CO32-+N2+6H2O;该实验说明电化学法处理CN-,影响处理速率的因素有负极的金属材料和甲中电解质的浓度(至少两条).
 ;
;
 铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
铁及其化合物在生活、生产中有广泛应用.请回答下列问题: