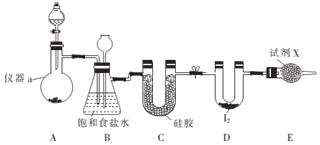
题目内容
6.按照要求回答问题:(1)写出下列反应的离子方程式:
①向石灰石中滴加盐酸CaCO3+2H+=CO2↑+H2O+Ca2+;
②向硫酸铜溶液中滴加氢氧化钠溶液Cu 2++2OH-=Cu(OH)2↓;
③写出Na与H2O反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑;
(2)除去Na2SO4 溶液中的Na2CO3杂质,选用的试剂是硫酸,写出对应反应的离子方程式CO32-+2H+=CO2↑+H2O.
(3)根据下面离子方程式写出化学方程式:
①Ca2++CO32-═CaCO3↓CaCl2+Na2CO3=CaCO3+2NaCl②OH-+HCO3-═CO32-+H2ONaOH+NaHCO3═Na2CO3+H2O.
分析 (1)①碳酸钙与盐酸反应生成氯化钙和二氧化碳、水;
②硫酸铜与氢氧化钠溶液反应生成氢氧化铜沉淀和硫酸钠;
③钠与水反应生成氢氧化钠和氢气;
(2)硫酸与碳酸钠反应生成硫酸钠和水、二氧化碳;
(3)①Ca2++CO32-═CaCO3↓可以表示可溶性钙盐与可溶性碳酸盐反应生成碳酸钙沉淀和水;
②OH-+HCO3-═CO32-+H2O表示可溶性强碱与可溶性碳酸盐反应生成可溶性碳酸盐和水.
解答 解:(1)①碳酸钙与盐酸反应生成氯化钙和二氧化碳、水,离子方程式:CaCO3+2H+=CO2↑+H2O+Ca2+;
故答案为:CaCO3+2H+=CO2↑+H2O+Ca2+;
②硫酸铜与氢氧化钠溶液反应生成氢氧化铜沉淀和硫酸钠,离子方程式:Cu 2++2OH-=Cu(OH)2↓;
故答案为:Cu 2++2OH-=Cu(OH)2↓;
③钠与水反应生成氢氧化钠和氢气,离子方程式:2Na+2H2O=2Na++2OH-+H2↑;
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(2)硫酸与碳酸钠反应生成硫酸钠和水、二氧化碳,离子方程式:CO32-+2H+=CO2↑+H2O;所以可以加入适量的稀硫酸除去硫酸钠中的碳酸钠;
故答案为:硫酸;CO32-+2H+=CO2↑+H2O;
(3)①Ca2++CO32-═CaCO3↓可以表示氯化钙与碳酸钠反应,方程式:CaCl2+Na2CO3=CaCO3+2NaCl,故答案为:CaCl2+Na2CO3=CaCO3+2NaCl;
②OH-+HCO3-═CO32-+H2O可表示氢氧化钠与碳酸氢钠反应,方程式为:NaOH+NaHCO3═Na2CO3+H2O,故答案为:NaOH+NaHCO3═Na2CO3+H2O.
点评 本题考查了离子方程式的书写、物质的分离与提纯,明确反应实质及除杂原则是解题关键,题目难度不大.

| A. | 标准状况下,1 mol CCl4的体积约为22.4L | |
| B. | NaOH的摩尔质量是40g | |
| C. | 常温常压下,11.2L氧气与足量铜粉充分反应,转移的电子数为2NA | |
| D. | 46g NO2 和46g N2O4 含有的原子数均为3NA |
| A. | KHCO3和MgCO3 | B. | K2CO3和Na2CO3 | C. | MgCO3和Na2CO3 | D. | KHCO3和NaHCO3 |
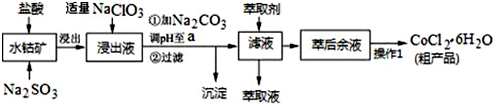
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)水钴矿进行预处理时加入Na2SO3的主要作用是将Fe3+、Co3+还原.
(2)写出NaClO3在浸出液中发生主要反应的离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)加Na2CO3调pH至a,a的取值范围是5.2≤a≤7.6;制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(4)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5
B.3.0~3.5
C.4.0~4.5
D.5.0~5.5
(5)CoCl2•6H2O溶解度随温度升高显著增大,所得粗产品通过重结晶方法提纯.
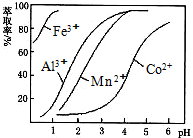
| A. | 两个电极均为铁片,M是阴极,电解质溶液是0.4%的NaOH溶液 | |
| B. | 两个电极均为石墨,M是阳极,电解质溶液是0.4%的H2SO4溶液 | |
| C. | 两个电极均为石墨,M是阳极,电解质溶液是0.4%的KOH溶液 | |
| D. | M是铁片,作阴极,N是石墨,电解质溶液是0.4%的KNO3溶液 |
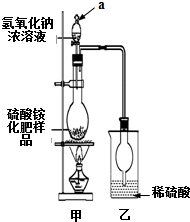 硫酸铵是一种常用的铵态氮肥.国家规定的质量标准如下:
硫酸铵是一种常用的铵态氮肥.国家规定的质量标准如下:| 指标 项目 | 优等品 | 一等品 | 合格品 |
| 外 观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |
[观察外观]该硫酸铵化肥无可见机械杂质.
[实验检测]
(1)通常实验室检验某样品是否为铵盐,是将样品与B(填序号,下同)共热,并用C或E检验产生的气体.
A.强酸 B.强碱 C.湿润的红色石蕊试纸D.湿润的蓝色石蕊试纸
E.用蘸有浓盐酸的玻璃棒 F.用蘸有浓硫酸的玻璃棒
(2)若按图所示装置进行实验.仪器a的名称是分液漏斗;烧瓶内发生反应的离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(3)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热,原因是:使硫酸铵充分反应完全转化为NH3,且全部进入烧杯乙.
[交流讨论]
(4)某同学根据此实验测得的数据,计算硫酸铵化肥的含氮量偏高(>21.2%),请分析实验装置中存在一个明显缺陷是:甲、乙装置间缺一个干燥装置.
[探究结论]
(5)用改进后的实验装置重新进行实验.称取13.5g硫酸铵化肥样品,测得实验前后乙装置增重3.40g.该化肥不是(填“是”或“不是”)一等品.
 ,A的结构式H-C≡C-H
,A的结构式H-C≡C-H 反应类型加聚反应;F生成B化学方程式HCl+CH2=CH2→CH3CH2Cl;
反应类型加聚反应;F生成B化学方程式HCl+CH2=CH2→CH3CH2Cl;