题目内容
5.化学与人类关系密切.下列有关物质的用途及其解释的说法正确的是( )| 物质用途 | 解释 | |
| A | 食醋浸泡水壶中的水垢 | 水垢中CaCO3溶于醋酸,酸性H2CO3>CH3COOH |
| B | 炒菜时加一点酒和醋 | 有酯类物质生成,使菜味香可口 |
| C | NaClO溶液可用作洗手液 | NaClO具有杀菌、消毒作用 |
| D | Al2O3可用作医药中的胃酸中和剂 | Al2O3能与胃酸反应,使胃液酸度降低 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.醋酸的酸性大于碳酸,食醋浸泡水壶中的水垢,发生强酸制取弱酸的反应;
B.酒和醋发生酯化反应生成有香味的酯类物质;
C.NaClO溶液具有强氧化性;
D.氧化铝、氢氧化铝均与酸反应,氢氧化铝与酸发生中和反应.
解答 解:A.水垢中CaCO3溶于醋酸,发生强酸制取弱酸的反应,可知酸性H2CO3<CH3COOH,故A错误;
B.炒菜时加一点酒和醋,酒和醋发生酯化反应有酯类物质生成,使菜味香可口,故B正确;
C.NaClO溶液具有强氧化性,NaClO具有杀菌、消毒作用,但不能用作洗手液,对皮肤有伤害,故C错误;
D.氧化铝与酸反应不是中和反应,氢氧化铝与酸发生中和反应,则氢氧化铝用作医药中的胃酸中和剂,使胃液酸度降低,故D错误;
故选B.
点评 本题考查物质的性质及用途,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用及化学与生活的关系,题目难度不大.

练习册系列答案
 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
15.在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g)△H=-92.3KJ/mol
反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为0.1MPa):
回答下列问题:
(1)3~4min,7~9min时段,反应处于平衡状态.
(2)第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是增大压强;平衡向正方向移动.(填“正”、“逆”或“不”)
(3)其他条件相同、催化剂不同时,S02的转化率随反应温度的变化如图a.260℃Cr2O3 (填Fe203、Ni0或Cr203)作催化剂反应速率最快.Fe2O3和Ni0作催化剂均能使S02的转化率达到最高,不考虑价格因素,选择Fe203的 主要优点是Fe2O3作催化剂时,在相对较低温度可获得较高SO2的转化率.
(4)科研小组在3800C Fe203作催化剂时,研究了不同投料比n(O2):n(SO2)对S02转化率的影响,结果如图b.请在答题卡坐标图中画出n(O2):n(SO2)=1:2时,SO2转化率的预期变化曲线.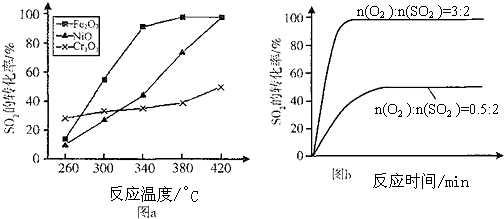
2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g)△H=-92.3KJ/mol
反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为0.1MPa):
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | w.9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | w0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
(1)3~4min,7~9min时段,反应处于平衡状态.
(2)第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是增大压强;平衡向正方向移动.(填“正”、“逆”或“不”)
(3)其他条件相同、催化剂不同时,S02的转化率随反应温度的变化如图a.260℃Cr2O3 (填Fe203、Ni0或Cr203)作催化剂反应速率最快.Fe2O3和Ni0作催化剂均能使S02的转化率达到最高,不考虑价格因素,选择Fe203的 主要优点是Fe2O3作催化剂时,在相对较低温度可获得较高SO2的转化率.
(4)科研小组在3800C Fe203作催化剂时,研究了不同投料比n(O2):n(SO2)对S02转化率的影响,结果如图b.请在答题卡坐标图中画出n(O2):n(SO2)=1:2时,SO2转化率的预期变化曲线.

17.下列说法正确的是( )
| A. | 标准状况下,1 mol CCl4的体积约为22.4L | |
| B. | NaOH的摩尔质量是40g | |
| C. | 常温常压下,11.2L氧气与足量铜粉充分反应,转移的电子数为2NA | |
| D. | 46g NO2 和46g N2O4 含有的原子数均为3NA |
14.由10g含有杂质的CaCO3和足量盐酸反应,产生了0.1molCO2,推断杂质的组成可能是( )
| A. | KHCO3和MgCO3 | B. | K2CO3和Na2CO3 | C. | MgCO3和Na2CO3 | D. | KHCO3和NaHCO3 |
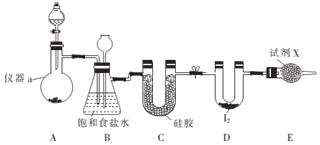
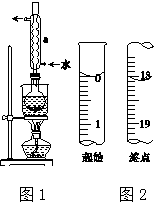 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.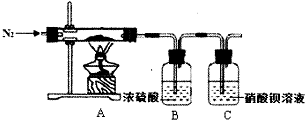 硫酸亚铁铵又称为摩尔盐,是一种重要的化工原料,其组成可表示为x(NH4)2S04•yFeS04•zH20.某兴趣小组探究组成中的x、y、z的数值.
硫酸亚铁铵又称为摩尔盐,是一种重要的化工原料,其组成可表示为x(NH4)2S04•yFeS04•zH20.某兴趣小组探究组成中的x、y、z的数值.