题目内容
正在火星上工作的美国“勇气”号、“机遇”号探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过H2O.以下叙述正确的是( )
| A、铝热剂就是单指Fe2O3粉和铝粉的混合物 |
| B、检验红砖中的红色物质是否是Fe2O3的操作步骤是:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
| C、分别还原a mol Fe2O3所需H2、Al、CO的物质的量之比为2:3:2 |
| D、明矾属硫酸盐,是纯净物 |
考点:铁的氧化物和氢氧化物
专题:几种重要的金属及其化合物
分析:A.可以发生铝热反应的混合物称之为铝热剂;
B.Fe2O3不溶于水,且和水不反应;
C.amolFe2O3被还原得到6amol电子,根据还原剂的化合价变化判断;
D.含有结晶水的化合物为纯净物.
B.Fe2O3不溶于水,且和水不反应;
C.amolFe2O3被还原得到6amol电子,根据还原剂的化合价变化判断;
D.含有结晶水的化合物为纯净物.
解答:
解:A.作为铝热剂重要组成的金属氧化物,铝热剂应为Al和过渡元素的氧化物所形成的混合物,故A错误;
B.Fe2O3不溶于水,且和水不反应,应加入盐酸或稀硫酸溶解后再加KSCN溶液,Fe2O3的检验过程:样品→粉碎→加酸溶解→过滤→向滤液中滴加KSCN溶液,故B错误;
C.amolFe2O3被还原得到6amol电子,则分别消耗H2、Al、CO3amol、2amol、3amol,物质的量之比为3:2:3,故C错误;
D.明矾为KAl(SO4)2?12H2O,是结晶水化合物,属于硫酸盐,为纯净物,故D正确.
故选D.
B.Fe2O3不溶于水,且和水不反应,应加入盐酸或稀硫酸溶解后再加KSCN溶液,Fe2O3的检验过程:样品→粉碎→加酸溶解→过滤→向滤液中滴加KSCN溶液,故B错误;
C.amolFe2O3被还原得到6amol电子,则分别消耗H2、Al、CO3amol、2amol、3amol,物质的量之比为3:2:3,故C错误;
D.明矾为KAl(SO4)2?12H2O,是结晶水化合物,属于硫酸盐,为纯净物,故D正确.
故选D.
点评:本题综合考查元素化合物知识,涉及铝热剂、离子的检验、氧化还原反应以及纯净物与混合物的判断,题目难度中等,注意相关知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
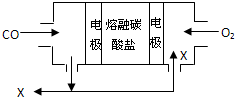 用熔融碳酸盐作电解质,CO、O2为原料组成的新型燃料电池如图所示,为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分X物质参与循环.下列说法错误的是( )
用熔融碳酸盐作电解质,CO、O2为原料组成的新型燃料电池如图所示,为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分X物质参与循环.下列说法错误的是( )| A、X物质的化学式为CO2 |
| B、通入O2的电极为正极 |
| C、负极的电极反应式为CO+CO32--2e-=2CO2 |
| D、电池工作时,转移0.5mol电子,理论上消耗O22.8L |
下列叙述正确的是( )
| A、乙酸所有原子处于同一平面,含有羧基,可与NaHCO3溶液反应生成CO2 |
| B、苯、乙醇和乙酸都能发生取代反应,乙酸乙酯和食用植物油均可水解生成乙醇 |
| C、乙烯、苯和聚乙烯都能使溴水褪色,褪色的原因相同 |
| D、在烃类有机物分子中,含有的氢原子个数一定是偶数 |
1mol某烷烃完全燃烧消耗的O2为1l mol,则其主链上含有5个碳原子的同分异构体(不考虑空间异构)有( )
| A、4种 | B、5种 | C、6种 | D、7种 |
NaCl是一种化工原料,可以制备一系列物质(如图).下列说法正确的是( )


| A、25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| B、石灰乳与Cl2的反应中,Cl2是氧化剂,Ca(OH)2是还原剂 |
| C、常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 |
| D、如图所示转化反应中有4个反应属于氧化还原反应 |
下列说法不正确的是( )
| A、工业上冶炼Fe用热还原方法 |
| B、海水淡化的方法主要有蒸馏法,电渗析法,离子交换法等 |
| C、工业上通过煤的干馏可获得芳香烃 |
| D、单质硅是将太阳能转变为电能的材料,二氧化硅可以做半导体材料 |
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
| A、X与Y形成化合物,X可以显负价,Y显正价 |
| B、第一电离能可能Y小于X |
| C、气态氢化物的稳定性:HmY小于HnX |
| D、最高价含氧酸的酸性:X对应的酸性弱于于Y对应的 |
有人认为CH2=CH2与Br2的加成反应,实质是Br2先断裂为Br+和Br-,然后Br+首先与CH2=CH2一端碳原子结合,第二步才是Br-与另一端碳原子结合.根据该观点如果让CH2=CH2与Br2在盛有NaCl和NaI的水溶液中反应,则得到的有机物是( )
| A、ICH2CH2I |
| B、ClCH2CH2Br |
| C、ClCH2CH2I |
| D、ClCH2CH2Cl |