题目内容
12.0.9molFe2O3与一定量CO反应后得到固体X,将X溶于足量稀盐酸,再通入0.5molCl2,恰好氧化完全.则X的组成及物质的量之比可能是( )| A. | 2:3混合的Fe3O4与FeO | B. | 3:5:4混合的Fe3O4、FeO与Fe | ||
| C. | 4:5混合的Fe2O3和FeO | D. | 1:1:4混合的Fe2O3、Fe3O4与FeO |
分析 先计算出0.9molFe2O3中含有铁元素的总物质的量,然后分别根据各选项中各组分的物质的量之比及质量守恒定律计算出各组分的物质的量,再根据电子守恒计算出消耗氯气的物质的量即可.
解答 解:A.若为2:3混合的Fe3O4与FeO,二者含有铁元素的物质的量之比为2:1,0.9molFe2O3中含有1.8mol铁离子,根据质量守恒定律,X中含有Fe3O4的物质的量为:1.8mol×$\frac{2}{3}$×$\frac{1}{3}$=0.4mol,含有FeO的物质的量为:1.8mol×$\frac{1}{3}$=0.6mol;根据电子守恒0.4mol Fe3O4完全反应消耗氯气的物质的量为:$\frac{0.4mol×3×(3-\frac{8}{3})}{2}$=0.2mol,0.6molFeO与氯气完全反应消耗氯气的物质的量为:$\frac{0.6mol×(3-2)}{2}$=0.3mol,总共消耗氯气的物质的量为0.2mol+0.3mol=0.5mol,满足条件,故A正确;
B.若为3:5:4混合的Fe3O4、FeO与Fe,三者含有的铁元素的物质的量之比为:9:5:4,则X中含有Fe3O4的物质的量为:1.8mol×$\frac{9}{18}$×$\frac{1}{3}$=0.3mol,含有FeO的物质的量为:1.8mol×$\frac{5}{18}$=0.5mol,含有Fe的物质的量为:1.8mol×$\frac{4}{18}$=0.4mol;0.3molFe3O4完全反应消耗氯气的物质的量为:$\frac{0.3mol×3×(3-\frac{8}{3})}{2}$=0.15mol,0.5molFeO与氯气完全反应消耗氯气的物质的量为:$\frac{0.5mol×(3-2)}{2}$=0.25mol,0.4mol铁与盐酸反应生成0.4mol氯化亚铁,0.4mol氯化亚铁完全反应消耗氯气的物质的量为:$\frac{0.4mol×(3-2)}{2}$=0.2mol,所以总共消耗氯气的物质的量为:0.15mol+0.25mol+0.2mol=0.6mol>0.5mol,故B错误;
C.若为4:5混合的Fe2O3和FeO,二者含有的铁元素的物质的量之比为8:5,则X中含有Fe2O3的物质的量为:1.8mol×$\frac{8}{13}$×$\frac{1}{2}$=$\frac{7.2}{13}$mol,含有FeO的物质的量为:1.8mol×$\frac{5}{13}$=$\frac{9}{13}$mol,氧化铁不消耗氯气,$\frac{9}{13}$molFeO消耗氯气的物质的量为:$\frac{9}{13}$mol×$\frac{3-2}{2}$=$\frac{9}{26}$mol,故C错误;
D.若为1:1:4混合的Fe2O3、Fe3O4与FeO,三者含有的铁元素的物质的量之比为:2:3:4,则X中含有Fe3O4的物质的量为:1.8mol×$\frac{3}{9}$×$\frac{1}{3}$=0.2mol,含有FeO的物质的量为:1.8mol×$\frac{4}{9}$=0.8mol,含有Fe2O3的物质的量为:1.8mol×$\frac{2}{9}$×$\frac{1}{2}$=0.2mol;0.2molFe3O4完全反应消耗氯气的物质的量为:$\frac{0.2mol×3×(3-\frac{8}{3})}{2}$=0.1mol,0.8molFeO与氯气完全反应消耗氯气的物质的量为:$\frac{0.8mol×(3-2)}{2}$=0.4mol,氧化铁与盐酸反应生成氯化铁,氯化铁不与氯气反应,则消耗氯气的总物质的量为:0.1mol+0.4mol=0.5mol,故D正确;
故选AD.
点评 本题考查了氧化还原反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.

 名校课堂系列答案
名校课堂系列答案| A. | H2S | B. | CO | C. | SO2 | D. | NH3 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向滴加有KSCN的FeCl2溶液,不断滴加氯水 | 溶液颜色先变红后褪色 | Fe2+先是被氧化为Fe3+,后来又被还原为Fe2+ |
| B | 向浓盐酸中加入少量碳酸钠溶液,将产生的气体通入苯酚钠溶液 | 苯酚钠溶液中出现白色浑浊 | 实验有缺陷,不能证明酸性:盐酸>碳酸>苯酚 |
| C | 在酸性KMnO4溶液中通入SO2 | 溶液褪色 | SO2具有漂白性 |
| D | 用标准浓度的烧碱溶液滴定未知浓度的盐酸,酚酞做指示剂 | 锥形瓶内溶液颜色由无色变为浅红色立即停止滴定 | 酸碱恰好中和 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 合成硫酸的工业尾气可以直接排入大气 | |
| B. | 进入接触室的气体,必须先经净化、干燥 | |
| C. | 从沸腾炉中排出的炉渣可以作为肥料 | |
| D. | 在高温、高压下由SO2和O2合成SO3 |
| A | B | C | D | |
| 实验装置 |  | 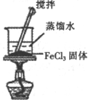 | 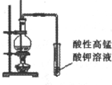 |  |
| 实验目的 | 比较非金属性强弱S>C>Si | 制取少量的Fe(OH)3胶体 | 证明乙醇与浓H2SO4共热生成了乙烯 | 比较不同催化剂的催化效果 |
| A. | A | B. | B | C. | C | D. | D |
| A. | X的氢氧化物是一种强碱 | B. | X元素位于第六周期 | ||
| C. | X的碳酸盐难溶于水 | D. | X的最高化合价为+2价 |
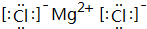 .
.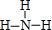 .
.