题目内容
4.下列叙述错误的是( )(1)若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q
(2)阴、阳离子通过静电吸引形成的化学键叫离子键
(3)H2O、H2S、H2Se的相对分子质量增大,所以熔沸点依次升高
(4)液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
(5)都是由非金属元素形成的化合物可能是共价化合物.
| A. | 全部 | B. | (1)(2)(3)(4) | C. | (1)(2)(3) | D. | (2)(3)(4) |
分析 (1)利用最高价含氧酸的酸性比较非金属性;
(2)离子键为静电作用;
(3)H2O分子间含氢键,沸点最高;
(4)稳定性与氢键无关;
(5)由非金属元素形成的化合物,可能为共价化合物或离子化合物.
解答 解:(1)利用最高价含氧酸的酸性比较非金属性,而R的含氧酸的酸性大于Q的含氧酸的酸性,不一定为最高价含氧酸,则不能比较非金属性,故错误;
(2)离子键为静电作用,则阴、阳离子通过静电吸引和排斥形成的化学键叫离子键,故错误;
(3)H2O分子间含氢键,沸点最高,则H2S、H2Se的相对分子质量增大,所以熔沸点依次升高,故错误;
(4)稳定性与氢键无关,非金属性F>Cl,则HF比HCl更稳定,故错误;
(5)由非金属元素形成的化合物,可能为共价化合物或离子化合物,如硝酸为共价化合物,硝酸铵为离子化合物,故正确;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质、元素周期律、化学键为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
12.下列措施是为了降低化学反应速率的是( )
| A. | 合成氨的反应中,选择“触媒”作催化剂 | |
| B. | 保存浓硝酸时,通常用棕色瓶并放在阴凉处 | |
| C. | 在试管中进行铝和氢氧化钠溶液反应时,稍微加热 | |
| D. | 用纯锌与稀硫酸反应制取氢气时,在溶液中加入少量硫酸铜溶液 |
15.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 0.1 molFeCl3水解生成的Fe(OH)3胶粒数为0.l NA | |
| B. | 标准状况下,2.24 L C10H22分子中共价键总数为31 NA | |
| C. | 电解精炼铜时,每转移l mol电子,阳极上溶解的铜原子一定小于0.5 NA | |
| D. | 25℃,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1 NA |
19.下列关于物质的分类错误的是( )
| A. | 同素异形体:活性炭,C60,石墨,金刚石 | |
| B. | 酸性氧化物:CO2,SO2,SiO2,Mn2O7 | |
| C. | 混合物:铝热剂,纯净矿泉水,液氯,漂白粉 | |
| D. | 非电解质:乙醇,四氯化碳,氨气,葡萄糖 |
9.设NA为阿伏加德罗常数值,下列说法不正确的是( )
| A. | 10 g D216O中所含中子数为5NA | |
| B. | 标准状况下,22.4 L乙烷中所含共价键数目为7NA | |
| C. | 7.8g Na2O2中所含阴、阳离子总数目为0.4NA | |
| D. | 密闭容器中,1 mol N2和3 mol H2充分反应后,容器中的分子数一定大于2NA |
16.4-溴甲基一1-环已烯的一种合成路线如下:
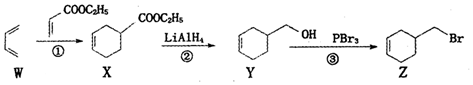
下列说法正确的是( )

下列说法正确的是( )
| A. | 烯烃W名称为1,3-丁二烯,所有原子一定在同一平面上 | |
| B. | ①、②、③的反应类型依次为加成反应、还原反应和取代反应 | |
| C. | 由化合物Z-步制备化合物Y的转化条件是:NaOH醇溶液,加热 | |
| D. | 化合物Y先经酸性髙锰酸鉀溶液氧化,再与乙醇在浓硫酸催化下酯化可得化合物X |
16.下列分子中,所有原子的最外层均为8电子结构的是( )
| A. | BeCl2 | B. | H2S | C. | CCl4 | D. | BF3 |
17. 研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:已知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),该反应放出热量2378.0 kJ,且白磷分子结构为正四面体,4个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物结构如图所示,则下表中X为( )
研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:已知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),该反应放出热量2378.0 kJ,且白磷分子结构为正四面体,4个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物结构如图所示,则下表中X为( )
 研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:已知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),该反应放出热量2378.0 kJ,且白磷分子结构为正四面体,4个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物结构如图所示,则下表中X为( )
研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:已知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),该反应放出热量2378.0 kJ,且白磷分子结构为正四面体,4个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物结构如图所示,则下表中X为( )| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | X | 499 | 434 |
| A. | 410 | B. | 335 | C. | 360 | D. | 188 |
 正确认识和使用电池有利于我们每一个人的日常生活如图所示装置中:
正确认识和使用电池有利于我们每一个人的日常生活如图所示装置中: