题目内容
15.设NA为阿伏加德罗常数,下列说法正确的是( )| A. | 0.1 molFeCl3水解生成的Fe(OH)3胶粒数为0.l NA | |
| B. | 标准状况下,2.24 L C10H22分子中共价键总数为31 NA | |
| C. | 电解精炼铜时,每转移l mol电子,阳极上溶解的铜原子一定小于0.5 NA | |
| D. | 25℃,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1 NA |
分析 A、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
B、标况下癸烷为液体;
C、电解精炼铜时,阳极上除了铜外,还有比铜活泼的杂质金属放电;
D、溶液体积不明确.
解答 解:A、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故得到的氢氧化铁胶粒的个数小于0.1NA个,故A错误;
B、标况下癸烷为液体,故不能根据气体摩尔体积来计算其物质的量,故B错误;
C、电解精炼铜时,阳极上除了铜外,还有比铜活泼的杂质金属放电,故当转移1mol电子时,阳极上溶解的铜原子小于0.5NA个,故C正确;
D、溶液体积不明确,故溶液中的氢氧根的个数无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
3.下列有关实验现象的描述不正确的是( )
| A. | 将表面变暗的金属钠粒投入干燥氯气中,无明显现象 | |
| B. | 将在空气中点燃的金属钠伸入干燥氯气中会继续燃烧,产生黄色火焰和大量黄烟 | |
| C. | 将SO2气体通入溴水中使溴水褪色,滴加BaCl2溶液有白色沉淀产生 | |
| D. | SO2气体通入品红溶液中,品红褪色,加热所得无色溶液红色复原 |
6.食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于3.5g/100mL.用中和滴定的方法可以测定食醋中醋酸的浓度,某白醋的醋酸浓度测定过程如图所示:
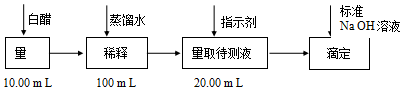
完成下列填空:
(1)稀释白醋时需要的仪器有烧杯、玻璃棒、胶头滴管、100mL容量瓶.
(2)应选用酚酞作为指示剂.达到滴定终点时,指示剂从无色变为浅红色.
(3)某同学一共进行了三次实验.以下是他设计的实验数据记录表,表格中A是滴定前读数,B是滴定后读数.
数据处理:消耗标准NaOH溶液的体积=21.32mL.
若测得稀释后白醋的浓度0.0594mol/L,则该食醋符合(选填“符合”、“不符合”)国家标准.
标准NaOH溶液通过以下步骤准备:①配制500mL浓度约为0.1mol/L的NaOH溶液;
②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度.
(4)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解,该配制步骤可行可行
(填“可行”或“不可行”).
(5)NaOH标准溶液的浓度需通过测定而不能直接配制的原因是NaOH固体在称量时容易吸收空气中的水和CO2,使配制所得的溶液浓度低于预期浓度,导致实验误差.

完成下列填空:
(1)稀释白醋时需要的仪器有烧杯、玻璃棒、胶头滴管、100mL容量瓶.
(2)应选用酚酞作为指示剂.达到滴定终点时,指示剂从无色变为浅红色.
(3)某同学一共进行了三次实验.以下是他设计的实验数据记录表,表格中A是滴定前读数,B是滴定后读数.
| 实验次数 | 稀释后白醋 体积(mL) | 标准NaOH溶液 | ||
| A | B | 消耗体积(mL) | ||
| 1 | 20.00 | 22.05 | ||
| 2 | 20.00 | 21.34 | ||
| 3 | 20.00 | 21.30 | ||
若测得稀释后白醋的浓度0.0594mol/L,则该食醋符合(选填“符合”、“不符合”)国家标准.
标准NaOH溶液通过以下步骤准备:①配制500mL浓度约为0.1mol/L的NaOH溶液;
②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度.
(4)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解,该配制步骤可行可行
(填“可行”或“不可行”).
(5)NaOH标准溶液的浓度需通过测定而不能直接配制的原因是NaOH固体在称量时容易吸收空气中的水和CO2,使配制所得的溶液浓度低于预期浓度,导致实验误差.
10.化学与社会、生活密切相关.对下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 碱性锌锰电池比普通锌锰电池性能好 | 锌在碱性介质中被氧化成更高价态 |
| B | 施肥时,草木灰(有效成分为K2CO3)不能与铵盐氮肥混合使用 | 它们反应生成氨气会降低肥效 |
| C | 配制FeCl2溶液时加入少量铁粉 | 抑制Fe2+的水解 |
| D | 纯水和干木头都不导电,但木头用水浸湿后却可以导电 | 水和干木头的某些成分发生化学反应 |
| A. | A | B. | B | C. | C | D. | D |
20.下列现象不是因发生化学变化而产生的是( )
| A. | 无水硫酸铜粉末遇水变蓝色 | |
| B. | 氢氧化铁胶体使水中悬浮物聚沉 | |
| C. | 盛在无色试剂瓶中的浓硝酸呈黄色 | |
| D. | FeSO4溶液久置于空气中,溶液呈黄色 |
7.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,5.6 LNO和5.6LO2混合后的分子总数为0.5 NA | |
| B. | 1mol乙烷分子含有8NA个共价键 | |
| C. | 58.5 g氯化钠固体中含有NA个氯化钠分子 | |
| D. | 标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA |
4.下列叙述错误的是( )
(1)若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q
(2)阴、阳离子通过静电吸引形成的化学键叫离子键
(3)H2O、H2S、H2Se的相对分子质量增大,所以熔沸点依次升高
(4)液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
(5)都是由非金属元素形成的化合物可能是共价化合物.
(1)若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q
(2)阴、阳离子通过静电吸引形成的化学键叫离子键
(3)H2O、H2S、H2Se的相对分子质量增大,所以熔沸点依次升高
(4)液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
(5)都是由非金属元素形成的化合物可能是共价化合物.
| A. | 全部 | B. | (1)(2)(3)(4) | C. | (1)(2)(3) | D. | (2)(3)(4) |
8.向Fe和Al2O3的混合物中加入足量稀硫酸将其溶解,室温下向所得溶液中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
| A. | 通入过量Cl2:Cl-、SO42-、Fe2+、Al3+ | |
| B. | 加入过量NaOH溶液:SO42-、Na+、AlO2-、OH- | |
| C. | 加入过量氨水:NH4+、SO42-、Na+、AlO2- | |
| D. | 加入过量NaNO3溶液:NO3-、SO42-、Fe2+、Al3+ |
