题目内容
7.氮及其化学物在合成化肥,药物等方面具有广泛用途.(1)已知反应:N2(g)+3H2(g)?2NH2(g)△H<0,现分别在200℃、400℃、600℃时,按n(N2):n(H2)=1:3向容器中投料发生该反应,当反应达到平衡时,体系中NH3的物质的量分数随压强的变化曲线如图1所示.

①曲线a对应的温度是200℃.
②关于工业合成氮的反应,下列叙述正确的是AD.
A.缩小容器体积可以提高H2的转化率.
B.M点对应N2的转化率是25%
C.如图1中M、N、Q三点平衡常数K的大小关系是K(M)=K(Q)<K(N)
D.若N点时c(NH3)=0.2mol•L-1,则此时该反应的化学平衡常数K≈0.93
(2)硫酸铵是培养酵母菌的氨源,酸性染料染色助染剂,常温下,向某硫酸钠溶液中滴加适量氨水,恰好使混合溶液呈中性,此时溶液中c(NH4+)=填“>”“<”或“=”)2c(SO42-).
(3)尿素(H2NCONH2)是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素的反应如下:
该反应实际为二步反应:
第一步:2NH3(g)+CO2(g)═H2NCOONH4(s)△H=-272kJ•mol-1 快
第二步:H2NCOONH4(s)═CO(NH2)2(s)+H2O(g)△H=+138kJ•mol-1 慢
Ⅰ.写出工业上以NH3、CO2为原料合成尿素的热化学方程式:2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2 (s)△H=-134kJ/mol.
Ⅱ.某实验小组模拟工业上合成尿素的条件,在一体积为0.5L的恒容密闭器中投入4mol氨气和1mol二氧化碳,实验测得反应中部分组成物质的量随时间的变化如图2所示.
①合成尿素总反应的快慢由二步反应决定.
②在0~10min内,第一步反应的速率v(NH3)=0.296mol•L-1•min-1.
③在图3中画出第二步反应的平衡常数K随温度T的变化曲线.
(4)利用氨气设计一种环保燃料电池,其工作原理如图4所示,一极通入氨气,另一极通入空气,电解质是掺杂氧化钇(Y2O2)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-.通入氨气的电极为负极(填“正极”或“负极”),写出负极的电极反应式:2NH3-6e-+3O 2-=N2+3H2O.
分析 (1)①相同压强下,升高温度平衡逆向移动,氨气含量降低;
②A.缩小容器体积相当于增大压强,平衡正向移动;
B.M点时氨的物质的量的分数为60%,利用三段式,设N2转化率是x
N2(g)+3H2(g)?2NH3(g)
起始 1 3 0
转化 x 3x 2x
平衡 1-x 3-3x 2x
$\frac{2x}{1-x+3-3x+2x}$=60%,计算x即为氮气转化率;
C.该反应的正反应是放热反应,升高温度平衡逆向移动,化学平衡常数减小;
D.N点时氨的物质的量的分数为20%,利用三段式,设N2转化率是b,N2的起始浓度为a,
根据反应N2(g)+3H2(g)?2NH3(g)
起始 a 3a 0
转化 ab 3ab 2ab
平衡 a-ab 3a-3ab 2ab
$\left\{\begin{array}{l}{\frac{2ab}{a-ab+3a-3ab+2ab}×100%=20%}\\{2ab=0.2}\end{array}\right.$
解得$\left\{\begin{array}{l}{a=0.3}\\{b=\frac{1}{3}}\end{array}\right.$,据此计算平衡常数K;
(2)溶液呈中性,则c(H+)=c(OH-),根据电荷守恒判断离子浓度;
(3)Ⅰ.将两个方程式相加即得NH3、CO2为原料合成尿素的热化学方程式,焓变进行相应的改变;
Ⅱ.①合成尿素总反应的快慢由第二步反应决定;
②在0~10min内,第一步反应的速率v(CO2)=$\frac{\frac{1-0.26}{0.5}}{10}$ mol•L-1•min-1=0.148mol•L-1•min-1,v(NH3)=2v(CO2);
③第二步的正反应是吸热反应,升高温度平衡正向移动;
(4)该燃料电池中,通入氨气的电极是负极,通入氧气的电极是正极,负极上氨气失电子和氧离子反应生成氮气和水,正极上氧气得电子生成氧离子.
解答 解:(1)①相同压强下,升高温度平衡逆向移动,氨气含量降低,根据图知,a、b、c的温度分别是200℃、400℃、600℃,故答案为:200℃;
②A.缩小容器体积相当于增大压强,平衡正向移动,氢气转化率增大,故A正确;
B.M点时氨的物质的量的分数为60%,利用三段式,设N2转化率是x
N2(g)+3H2(g)?2NH3(g)
起始 1 3 0
转化 x 3x 2x
平衡 1-x 3-3x 2x
$\frac{2x}{1-x+3-3x+2x}$=60%,x=75%,
故B错误;
C.该反应的正反应是放热反应,升高温度平衡逆向移动,化学平衡常数减小,M、Q温度相同其化学平衡常数相等,M温度小于N,则M化学平衡常数大于N,所以这三点化学平衡常数K(M)=K(Q)>K(N)
,故C错误;
D.N点时氨的物质的量的分数为20%,利用三段式,设N2转化率是b,N2的起始浓度为a,
根据反应N2(g)+3H2(g)?2NH3(g)
起始 a 3a 0
转化 ab 3ab 2ab
平衡 a-ab 3a-3ab 2ab
$\left\{\begin{array}{l}{\frac{2ab}{a-ab+3a-3ab+2ab}×100%=20%}\\{2ab=0.2}\end{array}\right.$
解得$\left\{\begin{array}{l}{a=0.3}\\{b=\frac{1}{3}}\end{array}\right.$,据此计算平衡常数K;
化学平衡常数K=$\frac{(2ab)^{2}}{(a-ab).(3a-3ab)^{3}}$=0.93,故D正确;
故选AD;
(2)混合溶液呈中性,所以c(H+)=c(OH-),根据电荷守恒得c(NH4+)+c(H+)=2c(SO42-)+c(OH-),则c(NH4+)=2c(SO42-),故答案为:=;
(3)I.2NH3(g)+CO2(g)═H2NCOONH4(s)△H1=-272kJ•mol-1;
H2NCOONH4(s)═CO(NH2)2(s)+H2O(g)△H2=+138kJ•mol-1;
则将两个方程式相加可得:2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2 (s)△H=△H1+△H2=-272kJ•mol-1+138kJ•mol-1=-134kJ/mol;
故答案为:2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2 (s)△H=-134kJ/mol;
II.①合成尿素总反应的快慢由第二步反应决定,
故答案为:二;
②在0~10min内,第一步反应的速率v(CO2)=$\frac{\frac{1-0.26}{0.5}}{10}$ mol•L-1•min-1=0.148mol•L-1•min-1,v(NH3)=2v(CO2)=2×0.148mol•L-1•min-1=0.296mol•L-1•min-1,
故答案为:0.296;
③第二步的正反应是吸热反应,升高温度平衡正向移动,平衡常数增大,其图象为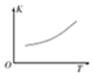 ,
,
故答案为: ;
;
(4)该燃料电池中,通入氨气的电极是负极,通入氧气的电极是正极,负极上氨气失电子和氧离子反应生成氮气和水,正极上氧气得电子生成氧离子,负极反应式为2NH3-6e-+3O 2-=N2+3H2O,
故答案为:负极;2NH3-6e-+3O 2-=N2+3H2O.
点评 本题考查较综合,涉及盖斯定律、原电池原理、化学平衡计算、化学平衡移动影响因素等知识点,为高频考点,侧重考查学生分析、计算及知识综合运用能力,注意:化学平衡常数只与温度有关,与物质转化率及物质浓度都无关,难点是电极反应式的书写,题目难度中等.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案| 时间t(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图1表示NO2变化曲线的是b.(填字母).
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
e.等温等容时,充入氦气 f.等温等压时充入氦气
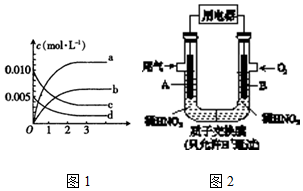
(4)若将2mol NO和1mol O2充入两个密闭容器中,保持一定温度进行反应:2NO(g)+O2(g)?2NO2(g),在恒压条件下达到平衡时生成amol NO2,在恒容条件下达到平衡时生成bmol NO2,则a、b的关系是:a>b
(5)某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如下图2所示,其中A、B为多孔材料.下列说法正确的是D
A.电解质溶液中电流的方向由B到A,电子的流向与之相反
B.该电池工作时,每转移4mol电子,消耗22.4L O2
C.电极B附近的c(NO3-)增大
D.电极A表面反应之一为NO-3e-+2H2O═NO3-+4H+.
Ⅰ.钠碱循环法脱硫技术
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式:2OH-+SO2═SO32-+H2O.
(2)NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当溶液呈中性时,离子浓度关系正确的是BC(填标号).
A.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
C.c(Na+)=2c(SO32-)+c(HSO3-)
Ⅱ.石灰石脱硫法
此法是以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放.但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率,相关反应的热化学方程式如下:
CaSO4(s)+CO(g)═CaO(s)+SO2(g)+CO2(g)△H1=218.4kJ•mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)═CaS(s)+4CO2(g)△H2=-175.6kJ•mol-1 (反应Ⅱ)
请回答下列问题:
(1)结合反应Ⅰ、Ⅱ写出CaSO4(s)与CaS(s)反应的热化学方程式3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g)△H=1049.2kJ•mol-1.
(2)对于气体参与的反应,表示平衡常数 Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅰ的Kp=$\frac{P(C{O}_{2})P(S{O}_{2})}{P(CO)}$(用表达式表示).
(3)假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图(如图1所示)其中正确的是B(填标号).
(4)图2为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线,则降低该反应体系中产生的SO2生成量的措施有AB(填标号).
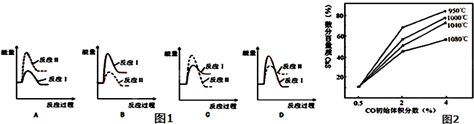
A.向该反应体系中投入生石灰 B.在合适的温度区间内控制较低的反应温度
C.降低CO的初始体积百分数 D.提高反应体系的温度.
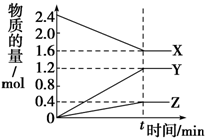 在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.
在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.(1)该反应的化学方程式是2X?3Y+Z
(2)根据化学反应2A(g)+5B (g)?4C(g),填写下表中的空白
| A | B | C | |
| 反应开始时浓度(mol/L) | 4.8 | 0 | |
| 2min后的浓度(mol/L) | 1.2 | 0.8 | |
| 2min内的浓度的变化(mol/L) | 0.4 | ||
| 化学学反应速率[mol/(L•min)] | 0.5 |
请回答下列问题:
(1)活性炭也可用于处理汽车尾气中的NO.在1L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量以及容器内压强如表:
| 活性炭/mol | NO/mol | A/mol | B/mol | ρ/Mpa | |
| 200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
| 335℃ | 2.005 | 0.0500 | 0.0250 | 0.0250 | ρ |
(2)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液.常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略SO32-的第二步水解,则Ksp(CaSO3)=4.2×10-9.
(3)尾气中的碳氢化合物含有甲烷,其在排气管的催化转化器中可发生如下反应CH4(g)+H2O(1)═CO(g)+3H2 (g)△H=+250.1kJ/mol.已知CO(g)、H2 (g)的燃烧热依次为283.0kJ/mol、285.8kJ/mol,请写出表示甲烷燃烧热的热化学方程式CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.3KJ/mol.以CH4(g)为燃料可以设计甲烷燃料电池,该电池以稀H2SO4作电解质溶液,其负极电极反应式为CH4-8e-+2H2O=CO2+8H+,已知该电池的能量转换效率为86.4%,则该电池的比能量为13.3kW•h•kg-1(结果保留1位小数,比能量=$\frac{电池输出电能(kW•h)}{燃料质量(kg)}$,lkW•h=3.6×106J).
 A、B的结构简式如图:
A、B的结构简式如图: 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)(△H<0)
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)(△H<0)