题目内容
19.根据中学化学常见的①CH3COOH;②HCl;③H2SO4三种溶液,请用A,B,C…等符号填空:A.①<②<③B.①=②=③C.①>②>③D.①<②=③E.①=③>②F.①>②=③G.①=②>③H.①=②<③
(1)当它们pH相同时,其物质的量浓度关系是C.
(2)当它们的物质的量浓度相同时,其pH的关系是C.
(3)中和等体积、等物质的量浓度的烧碱溶液,需同物质的量浓度的三种酸溶液的体积关系为G.
(4)当它们pH相同、体积相同时,同时加入锌,则开始时反应速率B,若产生相同体积的气体(相同状况),所需时间D.
(5)将pH相同的三种酸均稀释10倍后,pH关系为D.
分析 (1)pH=-lgc(H+),浓度相同,溶液pH大小由溶液中氢离子浓度大小分析计算判断;
(2)pH相同溶液中氢离子浓度相同,依据醋酸是弱酸,硫酸是二元酸分析判断;
(3)中和等量氢氧化钠,依据化学方程式中的电离关系计算判断;
(4)根据硫酸和盐酸为强酸,溶液中完全电离,醋酸为弱电解质,溶液中部分电离分析;
(5)根据稀释过程中盐酸和硫酸中氢离子浓度基本不变,而醋酸稀释后电离程度增大进行判断.
解答 解:(1)当它们pH相同时,溶液中氢离子浓度相同,假设提供1mol/L的氢离子,需要醋酸浓度应大于1mol/L,需要氯化氢溶液浓度为1mol/L,需要H2SO4 溶液浓度为0.5mol/L;其物质的量浓度大小排列顺序的是.①>②>③,
故答案为:C;
(2)当它们的物质的量浓度相同时,CH3COOH是弱酸部分电离,氢离子浓度最小;HCl是强酸完全电离,电离的氢离子大于醋酸;H2SO4是二元强酸,电离的氢离子浓度大于氯化氢,根据pH=-lgc(H+)可知,溶液的pH大小排列顺序是①>②>③;
故答案为:C;
(3)中和相同体积、相同物质的量浓度的烧碱溶液,假设氢氧化钠物质的量为1mol,需要③醋酸1mol,需要②HCl 1mol;需要①H2SO4 0.5mol;需相同物质的量浓度的三种酸溶液的体积大小关系为①=②>③;
故答案为:G;
(4)当它们的pH相同体积相同时,同时加入足量锌,若产生相同体积的气体(相同状况),硫酸和盐酸为强酸,PH相同,溶液中氢离子浓度相等,二者与锌反应生成氢气的速率相等,即①=②=③,而醋酸溶液中氢离子浓度减小,醋酸的电离程度增大,因此醋酸溶液中产生氢气的反应速率大于硫酸和盐酸的速率,所以反应时间大小关系为:③=②>①,
故答案为:B;D;
(5)将pH相同的三种酸均稀释10倍后,盐酸和硫酸中氢离子的物质的量基本不变,所以二者的pH相同,而醋酸在稀释过程中,电离程度增大,溶液中氢离子物质的量增大,溶液的pH小于盐酸和硫酸溶液的,所以pH关系为为:③=②>①,
故答案为:D.
点评 本题考查了酸碱反应中溶液性质及溶液pH计算,题目难度中等,题量稍大,注意醋酸为弱电解质溶液中部分电离、硫酸为二元强酸、盐酸为一元强酸,试题基础性强,侧重对学生灵活运用基础知识解决实际问题的能力的培养.

| A. | 用HCl溶液代替蒸馏水洗涤AgCl,可以减少沉淀损失 | |
| B. | 将BaSO4固体加入到饱和Na2CO3溶液中,充分反应后过滤、洗涤;往滤渣中滴加稀盐酸,有气体产生,则证明此条件下Ksp(BaSO4)>Ksp(BaCO3) | |
| C. | 向水中加入NaHCO3或NaHSO4固体后,水的电离程度均增大 | |
| D. | 对于乙酸乙酯的水解反应,加入稀硫酸可提高反应速率和乙酸乙酯的转化率 |
| A. | Al65Cu23Fe12的硬度比金属Al、Cu、Fe的硬度大 | |
| B. | Al65Cu23Fe12中三种金属的化合价均可视作零 | |
| C. | Al65Cu23Fe12不可用作长期浸泡在海水中的材料 | |
| D. | 1mol Al65Cu23Fe12溶于过量的硝酸时共失去265 mol电子 |
| A. | 用规格为10mL的量筒量取6.20mL的液体 | |
| B. | 称量氢氧化钠固体的质量时,将称量物放在滤纸上,并置于托盘天平的左盘,砝码放在托盘天平的右盘 | |
| C. | 利用蒸馏可除去液态混合物中沸点不同的易挥发、难挥发或不挥发的杂质 | |
| D. | 用四氯化碳萃取碘水中的碘,充分静置后紫红色液体在上层 |
| A. | a=4 | |
| B. | S2O32-是还原剂 | |
| C. | 将Y均匀分散到水中形成的体系具有丁达尔效应 | |
| D. | 每有3 mol Fe2+参加反应,反应中转移的电子总数为5 mol |
| A. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| B. | 1.7g NH3所含原子数为0.1NA | |
| C. | 通常状况下,NA个CO2分子占有的体积约为22.4L | |
| D. | 氧气和臭氧的混合物16 g中含有NA个氧原子 |
 Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解.
Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解.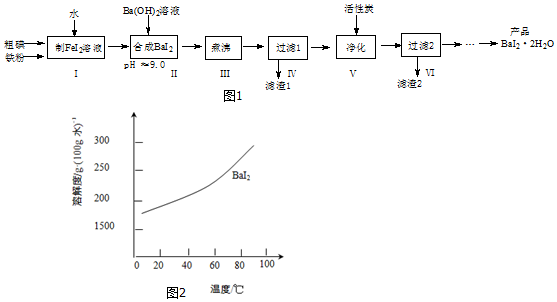
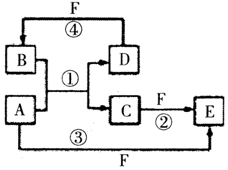 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出),请回答下列问题:
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出),请回答下列问题: ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.