题目内容
9.某学生为探究AgCl 沉淀的溶解和转化,设计实验方案并记录如下:步骤和现象
Ⅰ.将等体积等浓度的AgNO3 溶液和NaCl 溶液混合得到浊液W,过滤,得到滤液X 和白色沉淀Y
Ⅱ.向滤液X 中滴加几滴饱和Na2S 溶液出现浑浊
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S 溶液沉淀变为黑色
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水沉淀逐渐溶解
(1)步骤Ⅰ的浊液W 中存在的沉淀溶解平衡为AgCl(g)?Ag+(aq)+Cl-(aq).
(2)由步骤Ⅱ出现浑浊,说明AgCl 与Ag2S 的溶解度,哪个更小Ag2S.
(3)能说明步骤Ⅲ中沉淀变黑的离子方程式为2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq).
(4)已知:Ag++2NH3•H2O?Ag(NH3)${\;}_{2}^{+}$+2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因AgCl(g)
 Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解.
Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解.(5)结合上述信息分析,下列预测不正确的是BC.
A.在步骤Ⅳ之后,继续滴加浓硝酸后又有AgCl 沉淀生成
B.由步骤Ⅳ可以推测:实验室可用氨水洗涤银镜反应后的试管
C.若在白色沉淀Y 中滴加NaOH 溶液,沉淀也能溶解.
分析 Ⅰ.将等体积等浓度的AgNO3溶液和NaCl 溶液混合得到浊液W,过滤,得到滤液X 和白色沉淀Y,反应生成的沉淀Y为AgCl,滤液X中主要是硝酸钠;
Ⅱ.向滤液X 中滴加几滴饱和Na2S 溶液出现浑浊,说明滤液中含有银离子,说明银离子在加入氯化钠后不能完全沉淀;
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S 溶液沉淀变为黑色,生成沉淀为Ag2S,说明Ag2S溶度积较小,更难溶;
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水沉淀逐渐溶解,说明氯化银与氨水发生络合反应,可生成银氨络离子,以此解答该题.
解答 解:(1)将等体积等浓度的AgNO3溶液和NaCl溶液混合,反应生成AgCl白色沉淀,存在的沉淀溶解平衡为AgCl(g)?Ag+(aq)+Cl-(aq);
故答案为:AgCl(g)?Ag+(aq)+Cl-(aq);
(2)由步骤Ⅱ出现浑浊,说明Ag2S比AgCl溶解度更小,平衡向生成溶解度更小的方向移动,故答案为:Ag2S;
(3)该温度下,Ag2S比AgCl溶解度更小,氯化银转化成硫化银的反应为:2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq),
故答案为:2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq);
(4)在白色沉淀AgCl中,存在平衡:AgCl(g)  Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解,
Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解,
故答案为:AgCl(g)  Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解;
Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解;
(5)A.在步骤Ⅳ之后,继续滴加浓硝酸后,硝酸与氨水中和,生成Ag+,平衡左移,又有AgCl沉淀生成,故A正确;
B.由步骤Ⅳ可以推测:氨水可以结合Ag+,不能与Ag反应,实验室可不用氨水洗涤银镜反应后的试管,故B错误;
C.若在白色沉淀AgCl中滴加NaOH溶液,不发生反应,沉淀不能溶解,故C错误;
故答案为:BC.
点评 本题考查了性质实验方案的设计,为高频考点,题目难度较大,涉及难溶物溶度积的计算、氧化还原反应的配平、性质实验方案评价等知识,根据实验现象得出正确结论为解答关键,试题侧重考查学生的分析、理解能力及化学实验能力.

 名校课堂系列答案
名校课堂系列答案| A. | 过滤 | B. | 两种固体混合 | ||
| C. | 硫酸与氢氧化钠溶液的中和反应 | D. | 蒸发 |
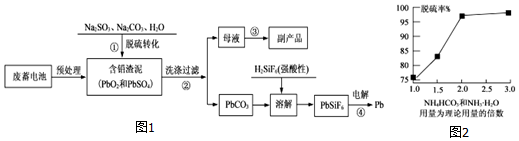
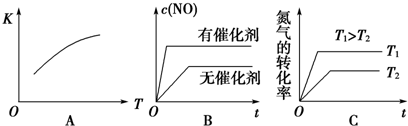
 如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题: